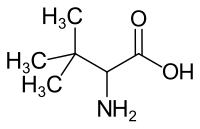
tert-Leucin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | tert-Leucin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H13NO2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 131,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
> 300 °C (Zersetzung)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
tert-Leucin (Terleucin) ist eine chirale, nicht-proteinogene α-Aminosäure. Strukturell kann tert-Leucin über die Substitution eines α-Wasserstoffatoms durch eine Aminogruppe (–NH2) von der 3,3-Dimethylbuttersäure abgeleitet werden.
tert-Leucin gehört zusammen mit seinen Konstitutionsisomeren Leucin, Isoleucin und Norleucin zur Stoffgruppe der Leucine.
Isomere
[Bearbeiten | Quelltext bearbeiten]tert-Leucin kommt in Form der beiden Enantiomere L-tert-Leucin [Synonym: (S)-tert-Leucin] und D-tert-Leucin [Synonym: (R)-tert-Leucin] vor.
| Isomere von tert-Leucin | ||
| Name | L-tert-Leucin | D-tert-Leucin |
| Andere Namen | (S)-(+)-tert-Leucin | (R)-(−)-tert-Leucin |
| Strukturformel | 
| |
| CAS-Nummer | 20859-02-3 | 26782-71-8 |
| 33105-81-6 (unspez.) | ||
| EG-Nummer | 606-659-6 | 607-998-2 |
| 608-831-6 (unspez.) | ||
| ECHA-Infocard | 100.109.056 | 100.115.718 |
| 100.133.521 (unspez.) | ||
| PubChem | 164608 | 6950340 |
| 306131 (unspez.) | ||
| Wikidata | Q2405866 | Q27466064 |
| Q27140135 (unspez.) | ||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]tert-Leucin kommt in der Natur als Baustein des Peptidantibiotikums Bottromycin A vor, das von dem Bodenbakterium Streptomyces bottropensis gebildet wird.[2] Daneben ist es Bestandteil einiger antimikrobiell wirkender mariner Schwämme.[3][4]
Darstellung
[Bearbeiten | Quelltext bearbeiten]L-tert-Leucin wird derzeit auf enzymatischem Wege im Tonnenmaßstab hergestellt[5] und soll als chirales Zwischenprodukt unter anderem bei der Synthese von Medikamenten zur Behandlung von Krebs oder AIDS zum Einsatz kommen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt L-tert-Leucine bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- ↑ D. Schipper: The revised structure of bottromycin A2. In: Journal of Antibiotics. Band 36, Nr. 8, August 1983, S. 1076–1077, PMID 6630058.
- ↑ N. Fusetani, S. Matsunaga: Bioactive sponge peptides. In: Chemical Reviews. Band 93, 1993, S. 1793–1806, doi:10.1021/cr00021a007.
- ↑ Lutz Krieg: Screening und Charakterisierung neuer Aminosäure-Amidasen zur Racematspaltung – Klonierung und Expression einer D-Amidase aus Variovorax paradoxus in E. coli. Dissertation, Heinrich-Heine-Universität Düsseldorf, 2002, S. 6, urn:nbn:de:hbz:061-20030609-000528-2 (PDF).
- ↑ A. Liese: Degussa L-tert-leucine process. In: Catalysis from A to Z: A Concise Encyclopedia. doi:10.1002/9783527809080.cataz04857.