Rhodanase
| Rhodanase | ||
|---|---|---|
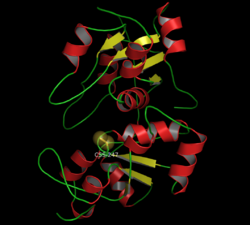
| ||
| Bändermodell der Rinder-Rhodanase mit persulfidiertem Cysteinrest C247 im katalytischen Zentrum (als Kalotte) nach PDB 1BOH | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 296 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | TST | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 2.8.1.1, Transferase | |
| Reaktionsart | Übertragung eines Schwefelatoms | |
| Substrat | Cyanid, Eisen, Sulfit, Persulfid | |
| Produkte | Thiosulfat, Thiocyanat, Schwefel/Eisen-Cluster | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Als Rhodanase, auch Schwefeltransferase, werden Enzyme bezeichnet, die Schwefel von Thiosulfat oder Persulfid auf andere Moleküle übertragen. Die Übertragung von Persulfid ist ein wichtiger Bestandteil der Sulfid-Oxidation, also der Entgiftung des konstant beim Cysteinabbau entstehenden Schwefelwasserstoffs. Mit der Übertragung von Schwefel auf Cyanide werden auch diese im Körper zu Thiocyanaten entgiftet. Die Übertragung auf Eisen produziert die als Kofaktor funktionierenden Eisen-Schwefel-Cluster. Rhodanasen sind in vielen Bakterien und Pilzen zu finden. Die Rhodanasen der Vielzeller sind in den Mitochondrien bzw. den Chloroplasten lokalisiert. Die TST vom Menschen zeigt außerdem schwache Mercaptopyruvat-Sulfurtransferase-Aktivität.[1][2]
Rhodanasen gehören zu den Sulfurtransferasen.
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]Die Reaktion findet in zwei Schritten statt.
Im ersten Schritt wird im katalytischen Zentrum des Enzyms die disulfidische Bindung gebildet, indem der Schwefeldonor, sein Schwefelatom auf die Thiolgruppe im Cysteinrest C247 unter Bildung eines Disulfans überträgt.
Im zweiten Schritt wird unter Rückbildung der Thiolgruppe das Substrat sulfidiert.
Das Hauptsubstrat ist das Persulfid der Sulfid:Chinon-Oxidoreduktase, das den Schwefel abgibt, der im zweiten Schritt auf Sulfit übertragen wird, das zu Thiosulfat wird.[2]
Bei der weniger wichtigen Cyanidsulfurierung ist Thiosulfat der Donor und Cyanid der Akzeptor des Schwefelatoms:
Die Wirksamkeit von Thiosulfat (z. B. in Form einer Natriumthiosulfatlösung) bei Cyanidvergiftungen beruht auch auf der Aktivierung dieses enzymatischen Entgiftungssystems.
Rhodanase als Domäne
[Bearbeiten | Quelltext bearbeiten]Die Aminosäuren 25–143 und 173–288 (bei Start-Met als 1) bilden jeweils eine katalytische Proteindomäne, welche auch in mehreren anderen Proteinen zu finden ist, wie beispielsweise Mercaptopyruvat-Sulfurtransferase und M-Phase-Inducer-Phosphatasen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- F. Gliubich, M. Gazerro, G. Zanotti, S. Delbono, G. Bombieri, R. Berni: Active Site Structural Features for Chemically Modified Forms of Rhodanese. In: Journal of Biological Chemistry. Band 271, Nr. 35, 1996, S. 21054–21061. PMID 8702871 PDF
- R. Cipollone, P. Ascenzi, P. Tomao, F. Imperi, P. Visca: Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese. In: Journal of Molecular and Microbiological Biotechnology. Bd. 15, Nr. 2,3, 2008, S. 199–211. PMID 18685272
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt Q16762
- ↑ a b T. M. Hildebrandt, M. K. Grieshaber: Three enzymatic activities catalyze the oxidation of sulfide to thiosulfate in mammalian and invertebrate mitochondria. In: The FEBS Journal Band 275, Nummer 13, Juli 2008, S. 3352–3361. doi:10.1111/j.1742-4658.2008.06482.x. PMID 18494801.




