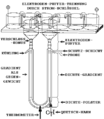
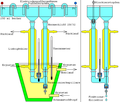
Dichtegradientenelektrophorese
Die Dichtegradientenelektrophorese ist ein Elektrophorese-Verfahren, das keine festen Träger-Substanzen verwendet. Daher wird sie auch als trägerfreie Elektrophorese bezeichnet. Die Dichtegradientenelektrophorese wurde von Arne Wilhelm Kaurin Tiselius im Jahre 1937 erstmals beschrieben.
Der Durchgang des elektrischen Stromes erzeugt unvermeidbar Widerstands-Wärme, und diese würde in einer Flüssigkeit eine thermische Konvektion bewirken. Bei der Dichtegradientenelektrophorese wird die thermische Konvektion der verwendeten Elektrolyt-Lösung durch einen Dichte-Gradienten verhindert.
Die Dichtegradientenelektrophorese ist eine besonders schonende Methode, Proteine mit hoher Molekülmasse voneinander zu trennen, weil die Proteine bei ihr mit keinem Festkörper wechselwirken müssen, und daher nicht belastet werden. Im Gegensatz zur Gelelektrophorese wandern große Moleküle hier nicht langsamer, weil hier keine Molekularsieb-Wirkung vorhanden ist. Ein weiterer Vorteil der Dichtegradientenelektrophorese gegenüber der Gelelektrophorese ist, dass nach dem Ende des Trennvorganges die Proteine bereits in gelöster Form vorliegen.
Neben den Proteinen können auch Nukleinsäuren, Ribosomen und ihre Untereinheiten, Organellen, sowie ganze Zellen getrennt werden. Für größere Partikel, wie zum Beispiel Ribosomen oder andere Organellen, sind Gelelektrophoresemethoden auf Grund der zu kleinen Maschenweite der Gele nicht geeignet. Die Dichtegradientenelektrophorese ist eine gute Ergänzung zur Dichtegradientenzentrifugation, weil bei diesen beiden Methoden in ähnlichen Puffermedien unterschiedliche Kraftwirkungen zur Trennung führen.
Die Nachteile der Dichtegradientenelektrophorese im Vergleich zu anderen Trennverfahren sind höherer Zeitaufwand und geringere Trennschärfe.
Bei dem hier abgebildeten System handelt es sich um eine weiter entwickelte Variante der Dichtegradientenelektrophorese aus dem Jahre 1972. Im Gegensatz zum System von Arne Wilhelm Kaurin Tiselius befindet sich das zu trennende Proteingemisch nicht an der tiefsten Stelle des U-Rohres, sondern in der Nähe des oberen Endes eines Dichtegradienten, was auf Kosten einer geringeren einsetzbaren Proteinmenge eine höhere Trennschärfe ermöglicht.

Als die Dichte erhöhende Substanzen für den Dichtegradienten kommen zum Beispiel Saccharose, Glycerin, Ficoll oder Schweres Wasser in Frage. Es ist erforderlich, dass keine der die Dichte erhöhenden Substanzen in wässriger Lösung eine elektrische Leitfähigkeit bewirkt. Saccharose und Glycerin haben zusätzlich den Vorteil, dass sie stabilisierend auf Proteine wirken. Ficoll ist auf Grund seiner geringen osmotischen Aktivität gut für lebende Zellen geeignet. Saccharose und Glycerin werden für den Dichtegradienten in Konzentrationen von 2 bis 70 Prozent (m/V, g/100ml) eingesetzt, bei höheren Konzentrationen wäre die Leitfähigkeit zu stark vermindert. In die untere Krümmung des U-Rohres wird mit Hilfe der höchsten Konzentration der Dichte-erhöhenden Substanz ein Dichtepolster eingebracht. Die Herstellung eines Dichtegradienten mit Hilfe eines Gradientenmischers ist unter Stoffgradient beschrieben.
Die Elektrolyt-Konzentrationen sollten zwischen 0,02 und 0,05 M liegen, weil sonst eine zu hohe Leitfähigkeit auftritt, was die Stromwärme erhöhen würde. Bei zu hoher Wärmeentwicklung würde der Dichtegradient zu thermischen Konvektionswirbeln zerfallen. Das Thermometer ist am tiefsten Punkt, der auch der Ort des höchsten elektrischen Widerstandes ist, eingebaut. An dieser Stelle sollte die Temperaturdifferenz zwischen dem dort vorhandenen Dichtepolster und dem Kühlwasser im Außenmantel nicht mehr als 2 Grad Celsius betragen. Im Gegensatz zu den die Dichte erhöhenden Substanzen ist die Elektrolyt-Konzentration im gesamten System konstant.
Als Elektrolyten sind Pufferlösungen von Salzen aus schwachen Basen mit schwachen Säuren besonders günstig, weil durch ihre Zersetzung an den Elektroden keine extremen pH-Werte auftreten. Falls die Proteine den Zusatz von Halogeniden der Alkalimetalle erfordern, dann kann man die an den Elektroden entstehenden starken Basen und Säuren durch die oben abgebildete Elektrodenpuffer-Trennung vom U-Rohr und den Proteinen fernhalten. Die Elektroden selbst können aus Platin oder Graphit bestehen.
Durch die Wahl des pH-Wertes der Pufferlösung, und durch die Lage von positiver und negativer Elektrode, kann man die Laufrichtung und die Lauf-Geschwindigkeit der Proteine beliebig beeinflussen. Dazu ist es noch möglich, das zu trennende Proteingemisch mit Hilfe der Dichte-erhöhenden Substanz an einer beliebigen Stelle des Dichtegradienten einzubringen.
Es ist auch möglich, dieses Dichtegradientensystem zur Elektrofokussierung zu verwenden, was fast immer zu einer sehr hohen Trennschärfe führt. Dabei befindet sich der organische Ampholyt nur im rechten Dichtegradienten, während der unten liegende Dichtepolster, der linke Dichtegradient, und der linke Elektrodenbecher verdünnte Phosphorsäure enthalten. Im rechten Elektrodenbecher befindet sich verdünnte Natronlauge. Diese Anordnung gilt nur, wenn die negative Elektrode rechts oben montiert ist. Eine Elektrodenpuffer-Trennung ist hier nicht notwendig. Ein Nachteil der trägerfreien Elektrofokussierung ist, dass manche Proteine am isoelektrischen Punkt unlöslich werden, und dadurch ausfallen.
Nach dem Ende des elektrischen Laufes wird der linke Ast des U-Rohres oben durch einen Stopfen verschlossen, und der rechte Dichtegradient durch eine Kapillare langsam abgelassen und in kleinere Volumina fraktioniert. Beim Ablassen nach dem Ende einer Elektrofokussierung muss sichergestellt werden, dass der Phosphorsäure-haltige Dichtepolster ausreichend weit unterhalb des oberen Endes der Kapillare verbleibt, weil sonst die Proteine geschädigt werden.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Jürgen Drews, Karl Bednarik, Hans Grasmuk: Elongation Factor 1 from Krebs II Mouse Ascites Cells: Purification, Structure and Enzymatic Properties. In: European Journal of Biochemistry. Band 41, Nr. 2, 1974, S. 217–227, doi:10.1111/j.1432-1033.1974.tb03263.x.
- Arne Tiselius: Electrophoresis of serum globulin: Electrophoretic analysis of normal and immune sera. In: Biochemical Journal. Band 31, Nr. 9, 1937, S. 1464, doi:10.1042/bj0311464, PMID 16746478, PMC 1267100 (freier Volltext).
- Arne Tiselius: A new apparatus for electrophoretic analysis of colloidal mixtures. In: Transactions of the Faraday Society. Band 33, Nr. 0, 1937, S. 524–531, doi:10.1039/TF9373300524.