Dioxoborsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
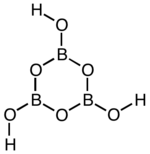
| ||||||||||||||||
| Vereinfachte Darstellung der Struktur, die in der ersten Form vorliegt | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dioxoborsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | HBO2 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 43,82 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Dioxoborsäure ist eine chemische Verbindung aus der Gruppe der Säuren. Formal kann sie auch der Stoffgruppe der Boroxine zugeordnet werden.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dioxoborsäure kann durch Erhitzung von Borsäure auf 100 bis 150 °C gewonnen werden. Es entsteht die dritte Form, wobei neben dessen Kristallen im Allgemeinen noch nicht umgewandelte Borsäure vorliegt. Bei zu langem Erhitzen entsteht daneben die zweite Modifikation.[2]
Eigenschaften
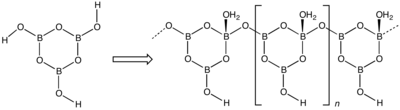
[Bearbeiten | Quelltext bearbeiten]Dioxoborsäure ist ein farbloser Feststoff, der in drei Modifikationen existiert[1] und sich in Wasser unter Bildung von Orthoborsäure löst. Die Umwandlung der dritten Form in die zweite Form erfolgt bei 160 °C rasch. Durch weiteres Erhitzen auf 160 °C und höher geht diese schließlich in die erste Modifikation über.[2] Bei mehr als 500 °C zersetzt sie sich zu Bortrioxid.[5] Die dritte Modifikation kristallisiert orthorhombisch (a = 801,5 pm, b = 967,9 pm, c = 624,4 pm) mit der Raumgruppe Pnma (Raumgruppen-Nr. 62), die zweite monoklin (a = 712,2 pm, b = 884,2 pm, c = 677,1 pm, β = 93,26°) mit der Raumgruppe P21/c (Nr. 14) und die erste kubisch (a = 888,6 pm) mit der Raumgruppe P43n (Nr. 218).[2][1] Im planaren Boroxin-Ring der ersten Form (HBO2)n und ihrer Salze sind (p-p)π-Bindungen vorhanden. Die Bindungsabstände liegen zwischen denen von Einfach- und Doppelbindungen. In der zweiten und dritten Form sind die Boroxinringe über Sauerstoffatome miteinander verknüpft, wobei sich die zweite Form kettenförmig und die dritte Form sich dreidimensional verknüpft.[5] Die β-Metaborsäure setzt sich also aus endlosen Zickzack-Ketten der Zusammensetzung [B3O4(OH)(OH2)]n zusammen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 316 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g h i j Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 808.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–53 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Metaboric acid 99% bei Sigma-Aldrich, abgerufen am 22. Mai 2015 (PDF).
- ↑ a b Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 582 (eingeschränkte Vorschau in der Google-Buchsuche).

