Hexamethylentetramin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Methenamin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H12N4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle mit aminartigem Geruch[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 140,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||

Hexamethylentetramin (auch Methenamin oder Urotropin) ist ein farbloses kristallines Pulver. Die chemische Struktur von Hexamethylentetramin lässt sich vom Kohlenwasserstoff Adamantan ableiten: Beim Hexamethylentetramin sitzen an den vier Verknüpfungsstellen der drei Sechserringe Stickstoffatome. Zwischen den Stickstoffatomen (als Eckpunkte eines Tetraeders) liegt jeweils eine CH2-Gruppe.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Hexamethylentetramin wurde erstmals 1859 von Alexander Michailowitsch Butlerow beschrieben.[7] 1894 wurde es unter dem Warenzeichen Urotropin zur Desinfektion der Harnwege in die Therapie eingeführt.[8]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Hexamethylentetramin entsteht aus Ammoniak und Formaldehyd in wässriger Lösung:[4]

Diese Reaktion wird bei der sogenannten Formol-Titration bei der Bestimmung von Ammoniumverbindungen eingesetzt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Der Flammpunkt liegt bei 250 °C, die Zündtemperatur bei 390 °C und die Zersetzungstemperatur bei > 263 °C.[4] Die Energiedichte, Brennwert beträgt 31,3 MJ/kg, der pH-Wert liegt bei 8,4 bei 28 g/l und der pKs-Wert bei 8,95 (20 °C).[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexamethylentetramin dient zur Herstellung von Amino- und Phenoplasten und als Lebensmittelkonservierungsstoff (E 239, selten verwendet, nur zugelassen in Provolone-Käse). In gepresster Form wird es auch als Trockenbrennstoff gebraucht und ist der Hauptbestandteil der Brennstoffe Esbit und von Meta Tabletten der Firma Lonza – in Form quaderförmiger Tabletten mit grauen Markierungsflecken.
In der Histochemie wird Hexamethylentetramin bei Silberfärbungen eingesetzt.
In der organischen Synthese dient es als Formyläquivalent (Duff-Reaktion), zur Einführung von Aminogruppen, zur Synthese von N-Heterocyclen und wird in der Mannich-Reaktion verwendet. In der anorganischen Analytik dient es im Kationen-Trennungsgang als Puffersubstanz bei der Fällung der „Urotropin-Gruppe“ (zu der auch Eisen, Chrom und Aluminium gehören) bei pH 5,5. In saurer wässriger Lösung zerfällt Methenamin in Formaldehyd und Ammoniumionen. Deshalb führt sublimiertes Hexamethylentetramin bei der Emissionsmessung während der Herstellung von Phenolharzen zu überhöhten Formaldehyd-Konzentrationen bei Messverfahren, die mit sauren Lösungen arbeiten. In diesem Zusammenhang sind das DNPH-Verfahren[9] und das MBTH-Verfahren[10] zu nennen.
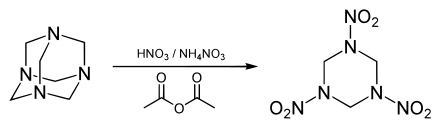
Hexamethylentetramin ist ein Ausgangsstoff zur Herstellung der Sprengstoffe Hexogen, Oktogen, Dinitrohexamin und HMTD. Als solcher unterliegt es der Verordnung (EU) Nr. 2019/1148 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe (Anhang II).[11]
In der Gießereitechnik wird es zusammen mit Phenolharz als Harz-Härter-System für das Maskenformverfahren zur Herstellung von Formschalen und Hohlkernen verwendet.
Eine weitere Verwendung ist die Neutralisation saurer Nebenprodukte bei der Synthese des chemischen Kampfstoffes Sarin, weswegen der Nachweis von Hexamin (= Hexamethylentetramin) in Kampfgebieten als ein Indiz für einen Sarineinsatz gelten kann.[12][13]
Medizinisch findet Hexamethylentetramin (Freiname: Methenamin) Verwendung gegen übermäßige Transpiration, z. B. an den Händen, Füßen oder Achseln (Handelsname: Antihydral, fettfreie Paste[14]).[15][16] In seiner Verwendung als Desinfizienz bei Harnwegsinfekten wurde Methenamin (Urotropin) durch Antibiotika verdrängt.[8] Die Wirkung beruht auf der Abspaltung von Formaldehyd in saurem Milieu, weswegen es mit harnansäuernden Substanzen (Camphersäure, Anhydromethylencitronensäure u. a.) kombiniert wurde.[17]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu E 239: Hexamethylene tetramine in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ Eintrag zu METHENAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c d e f g Eintrag zu Hexamethylentetramin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu Hexamethylentetramin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Juli 2019.
- ↑ a b Europäisches Arzneibuch. 8. Ausgabe, Grundwerk 2014, S. 4065.
- ↑ Eintrag zu Methenamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Alexander Butlerow: Ueber einige Derivate des Jodmethylens. In: Annalen der Chemie und Pharmacie. 111, 1859, S. 242–252, doi:10.1002/jlac.18591110219.
- ↑ a b H. Auterhoff: Lehrbuch der Pharmazeutischen Chemie. WVG 1978, S. 179.
- ↑ VDI 3862 Blatt 2:2000-12 Messen gasförmiger Emissionen; Messen aliphatischer und aromatischer Aldehyde und Ketone nach dem DNPH-Verfahren; Gaswaschflaschen-Methode (Gaseous emission measurement; Measurement of aliphatic and aromatic aldeydes and ketones by DNPH method; Impinger method). Beuth Verlag, Berlin, S. 4.
- ↑ Hans-Günter Haub, Sigrid Mühlhauser, Franz-Josef Müller, Arno Gardziella: Messung von Emissionen bei der Aushärtung von Phenolharzen. In: Staub – Reinhalt. Luft, 1988, 48, Nr. 4, S. 145–149.
- ↑ Verordnung (EU) 2019/1148 des Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe, zur Änderung der Verordnung (EG) Nr. 1907/2006 und zur Aufhebung der Verordnung (EU) Nr. 98/2013.
- ↑ Laut dem Nachrichtenmagazin Spiegel heißt es in einem Bericht des französischen Außenministeriums: „Außerdem weist die Präsenz des Hexamins darauf hin, dass dieser Herstellungsprozess vom Wissenschafts- und Forschungszentrum des syrischen Regimes entwickelt wurde.“ Syrienkrieg: Frankreich macht Assad für Sarin-Angriff verantwortlich. In: Spiegel Online. 26. April 2017, abgerufen am 1. November 2017.
- ↑ Christoph Sydow: C-Waffen in Syrien: Assad-Regime liefert selbst Beweis für Sarin-Attacke. In: Spiegel Online. 5. Juli 2017, abgerufen am 1. November 2017.
- ↑ Fachinformation Antihydral. Robugen GmbH. Stand Juli 2022.
- ↑ Rote Liste online, Stand: 12. Dezember 2009.
- ↑ Ch. Weber: Hyperhidrosis – wenn der Schweiß ausbricht. DAZ.online, Nr. 31/2006.
- ↑ H. Auterhoff: Wörterbuch der Pharmazie. Band 1: Pharmazeutische Biologie, Pharmazeutische Chemie, Pharmazeutische Technologie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1981, ISBN 3-8047-0656-8, S. 262.