Vanadium(II)-fluorid
(Weitergeleitet von Vanadiumdifluorid)
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
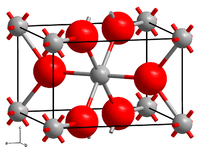
| |||||||
| _ V2+ _ F− | |||||||
| Allgemeines | |||||||
| Name | Vanadium(II)-fluorid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | VF2 | ||||||
| Kurzbeschreibung |
blaues, kristallines Pulver[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 88,938 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Löslichkeit |
löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Vanadium(II)-fluorid ist eine chemische Verbindung der Elemente Vanadium und Fluor. Es ist ein blaues, kristallines Pulver.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Vanadium(II)-fluorid kann durch Reduktion von Vanadium(III)-fluorid mit Wasserstoff in einer Fluorwasserstoff-Lösung bei 1150 °C gewonnen werden:[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Vanadium(II)-fluorid kristallisiert im tetragonalen Kristallsystem in der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) mit den Gitterparametern a = 480,4 pm und c = 323,7 pm.[5]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Vanadium(II)-fluorid ist ein starkes Reduktionsmittel, das sogar Stickstoff in Anwesenheit von Magnesiumhydroxid zu Hydrazin reduziert.[2]
Es löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen:[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Vanadium(II)-fluorid auf webelements.com
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1550.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Lothar Kolditz: Anorganische Chemie Teil 2. VEB Deutscher Verlag der Wissenschaften, Berlin, 1980, S. 641.
- ↑ J. W. Stout, W. O. J. Boo: Crystalline vanadium (II) fluoride, VF2. Preparation, structure, heat capacity from 5 to 300 °K and magnetic ordering. In: The Journal of Chemical Physics. 71, 1, 1979, S. 1–8, doi:10.1063/1.438115.

![{\displaystyle \mathrm {V^{2+}+6\ H_{2}O\longrightarrow [V(H_{2}O)_{6}]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/51eac504cd2c785508c492ed7e81651389442813)