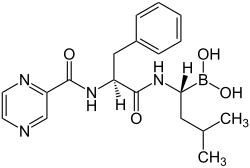
Bortezomib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Bortezomib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C19H25BN4O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Proteasom-Inhibitor | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 384,24 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||

Bortezomib ist ein Arzneistoff, der zur Therapie des multiplen Myeloms (Plasmozytom) zugelassen ist. Bortezomib ist der erste Vertreter einer neuen Wirkstoffklasse, der Proteasom-Inhibitoren, und wird als Injektionspräparat unter dem Markennamen Velcade in den USA von Millennium Pharmaceuticals, einem Tochterunternehmen von Takeda Pharma, und in Deutschland von Janssen-Cilag, einem Tochterunternehmen von Johnson & Johnson vertrieben.
Indikation
[Bearbeiten | Quelltext bearbeiten]In der EU ist Bortezomib seit dem 26. April 2004[2] zur Monotherapie für die Behandlung von progressivem multiplem Myelom bei Patienten zugelassen, die mindestens eine vorangehende Therapie durchlaufen haben und die sich bereits einer Knochenmarktransplantation unterzogen haben oder die für eine Knochenmarktransplantation nicht geeignet sind.[3][4]
Seit dem 28. August 2008[5] ist Bortezomib in Kombination mit Melphalan und Prednison für die Behandlung erwachsener Patienten mit bisher unbehandeltem multiplem Myelom zugelassen, die für eine Hochdosis-Chemotherapie mit Knochenmarktransplantation nicht geeignet sind.
Eventuell kann Bortezomib auch mit anderen Medikamenten zur Behandlung des bisher unbehandelten multiplen Myeloms eingesetzt werden. Im Jahr 2019 haben Piechotta et al. eine Cochrane-Übersichtsarbeit mit einer Netzwerk-Meta-Analyse von randomisierten kontrollierten Studien durchgeführt, um die Sicherheit und Wirksamkeit von multiplen Medikamentenkombinationen für Erwachsene mit einem neu-diagnostizierten und unbehandelten multiplen Myelom zu vergleichen. Die Studienteilnehmer mussten entweder älter als 65 Jahre sein oder ungeeignet für eine Stammzelltransplantation oder Hochdosistherapie sein, wenn sie zwischen 18 und 65 Jahre alt waren. Bortezomib wurde in den folgenden Kombinationen evaluiert: Bortezomib plus Melphalan und Prednison & fortlaufend Bortezomib plus Lenalidomid plus Dexamethason. Wenn möglich, wurden diese Kombinationen mit Melphalan plus Prednison verglichen, da diese Kombination die Therapie mit dem medianen Risiko darstellt. Es ergaben sich die folgenden Ergebnisse: Die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursacht wahrscheinlich eine Erhöhung des Gesamtüberlebens. Bortezomib plus Melphalan und Prednison verursacht eventuell eine starke Verlängerung des Gesamtüberlebens. Bortezomib plus Melphalan und Prednison und die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursachen vielleicht eine starke Verlängerung des progressionsfreien Überlebens. Bortezomib plus Melphalan und Prednison führt wahrscheinlich zu einer ausgeprägten Erhöhung des Risikos für Polyneuropathien. Die andere Medikation wurde hier nicht verglichen. Die Gabe von Bortezomib plus Melphalan und Prednison verursacht wahrscheinlich eine Erhöhung der schweren unerwünschten Ereignisse. Die andere Medikation wurde hier nicht verglichen. Die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursacht eine ausgeprägte Erhöhung des Abbruchs der Studie seitens der Patienten wegen unerwünschten Ereignissen. Die Gabe von Bortezomib plus Melphalan und Prednison verursacht wahrscheinlich eine schwache Erhöhung des Studienabbruchs durch Patienten wegen unerwünschten Ereignissen.[6]
Bortezomib wird in klinischen Studien für weitere Indikationen, wie zum Beispiel für andere hämatologische Krebsformen und solide Tumoren erprobt. Parallel dazu wird die Wirksamkeit bei Kolon-, Lungen-, Pankreas-, Brust-, Prostata- und Ovarialkrebs und Non-Hodgkin-Lymphomen geprüft.[7] Außerdem wird der Stoff in der experimentellen Behandlung der Anti-NMDA-Rezeptor-Enzephalitis eingesetzt.
Applizierung und Dosierung
[Bearbeiten | Quelltext bearbeiten]Der Wirkstoff liegt als gefriergetrocknetes Pulver in Form eines Mannitesters mit der Boronsäuregruppe vor und muss vor der Verabreichung in Kochsalzlösung für Injektionszwecke aufgelöst werden. Nach der Zubereitung steht der Mannitolester im Gleichgewicht mit seinem Hydrolyseprodukt.[8]
Bortezomib wird intravenös oder subkutan injiziert, die empfohlene Dosis liegt bei 1,3 mg pro m2 Körperoberfläche. Zur Vorbeugung kann ein Mittel gegen Übelkeit verabreicht und anschließend noch mit Kochsalzlösung (etwa 50 ml) nachgespült werden. Eine Kontrolle des Blutbildes vor jeder Injektion ist empfohlen. Dabei sollte beispielsweise die Thrombozytenzahl, die Leukozytenzahl und der Hämoglobin-Wert überwacht werden. Alle drei Werte können sich während der Therapie verringern. Die Dauer der Behandlung ist abhängig vom Ansprechen der Erkrankung, mehr als 8 Zyklen werden in der Regel nicht gegeben. In der SUMMIT-Studie wurden alle Patienten, bei denen die Krankheit nicht fortschritt und die keine schwerwiegenden Nebenwirkungen aufwiesen, mit 8 Zyklen behandelt.[2]
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Proteasome spielen eine wichtige Rolle bei dem Abbau von Proteinen, die den Zellzyklus und somit Zellwachstum regulieren. Die Wirkung von Bortezomib basiert auf einer Blockierung der Stoffwechselwege der Krebszellen, die sich durch unkontrolliertes Wachstum kennzeichnen. Kommt es zu einer Proteasom-Blockade, werden vitale Proteolyse-Prozesse unterdrückt.[7]
Dies führt dazu, dass sich viele Signale in der Krebszelle gegenseitig aufheben oder verhindert werden. Im Ergebnis führt dies zur
- Hemmung des Tumorwachstums
- Hemmung der Angiogenese (Ausbildung neuer Blutgefäße zur Versorgung des Tumors)
- Apoptose der Krebszellen (programmierter Zelltod der vorher „unsterblichen“ Krebszellen)
- Hemmung der Interaktion mit Bindegewebszellen des Knochenmarks.[2]
Auch gesunde Zellen sind von der Therapie betroffen. Allerdings wurde festgestellt, dass sich diese Zellen – im Gegensatz zu den Krebszellen – wieder regenerieren, wenn die Behandlung turnusgemäß nach 4 Injektionen an den Tagen 1, 4, 8 und 11 für zehn Tage unterbrochen wird. Offensichtlich sind Krebszellen besonders auf die Funktion der Proteasomen angewiesen und reagieren daher empfindlicher auf deren Hemmung als normale Zellen.[2] Das Boratom des Bortezomib bindet mit einer hohen Affinität und Selektivität als Ligand an die katalytische Funktion des 26S-Proteasoms.
Über das Bor erfolgt eine hochspezifische und hochaffine Bindung an die katalytische Stelle des 26S-Proteasoms, das dadurch gehemmt wird.[9]
Das multiple Myelom (Plasmozytom) gilt bisher als behandelbar, aber unheilbar. Bortezomib kann zwar auch keine Heilung bewirken, ist aber eine weitere Alternative für die Patienten, bei denen mindestens eine Therapie bereits fehlgeschlagen ist.
Metabolismus
[Bearbeiten | Quelltext bearbeiten]Nach einmaliger intravenöser Gabe nehmen die Plasmakonzentrationen von Bortezomib biphasisch ab. Die Abnahme wird durch eine schnelle Verteilungsphase, gefolgt von einer langsameren terminalen Eliminationsphase charakterisiert. Beim Menschen beträgt die Halbwertzeit geschätzte 5 bis 15 Stunden. In vitro wurden die Cytochrom Enzyme CYP3A4 und CYP2C19 als Hauptenzyme der Metabolisierung identifiziert. Im Urin wurde nur ein kleiner Anteil der nicht-metabolisierten Ausgangssubstanz nachgewiesen, während kein intaktes Bortezomib in der Galle oder den Fäzes gefunden wurde.[8]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Die wichtigste Nebenwirkung, welche die Behandlung mit Bortezomib auch im Wesentlichen begrenzt, ist die periphere Neuropathie, eine Nervenstörung mit Schmerzen und Taubheitsgefühlen, vor allem an Händen oder Füßen. Diese Nebenwirkung ist therapeutisch nur schwer beeinflussbar und kann den Patienten sehr stark beeinträchtigen. Nach Literaturangaben sind bis zu 70 % der Patienten hiervon betroffen und die Ausprägung kann schwer bis sehr schwer sein (Grad III-IV nach WHO) und bis zur völligen Immobilität der Patienten führen. In diesen Fällen ist die Lebensqualität der Patienten ganz erheblich und über Monate eingeschränkt. In der Regel bildet sich die Neuropathie wieder zurück,[10] kann aber sehr lange Zeit anhalten.
Eine Studie hat gezeigt, dass periphere Neuropathie deutlich seltener auftrat, wenn Bortezomib subkutan anstatt intravenös verabreicht wurde,[11] daher wurde diese Applikationsform im September 2012 von der EU-Kommission zugelassen.
Weitere Nebenwirkungen, wie beispielsweise Erniedrigung der Blutzellwerte (siehe oben), Übelkeit, Durchfall und Fatigue (schwere Erschöpfung) können auftreten.
Therapiekosten
[Bearbeiten | Quelltext bearbeiten]In Großbritannien verursacht Bortezomib Therapiekosten von 18.000 GBP pro Jahr und Patienten. Obwohl das Medikament in klinischen Studien die Lebenszeit um mehrere Monate verlängerte, lehnte der staatliche britische Gesundheitsdienst (NHS) in einem ersten Entwurf eine Kostenübernahme ab. Das National Institute for Health and Clinical Excellence (NICE) prüft für den NHS die Kosten-Effektivität neuer Therapien. Ein Maßstab sind dabei die Kosten, die für den Gewinn eines Lebensjahres in guter Lebensqualität (quality-adjusted life years, QALY) aufgewendet werden müssen. Gefordert wird häufig ein Wert von unter 30.000 GBP pro QALY.
Nach mehrmonatigen Verhandlungen mit dem Hersteller machte das NHS im Jahr 2007 daraufhin folgende Zusage: Auf eine Anregung des Herstellers hin sollen alle Patienten, für die Bortezomib indiziert ist, das Medikament zunächst über maximal vier Zyklen erhalten. Wird während dieser Zeit eine Remission des multiplen Myeloms erzielt, wird die Therapie auf Kosten des NHS fortgesetzt. Wird keine Remission erzielt, wird die Therapie abgebrochen und das NHS muss die eingesetzten Medikamente nicht bezahlen.[12]
Faktisch bedeutet dies, dass das NHS nur in den Fällen für die Therapie bezahlen muss, in denen das Medikament gewirkt hat.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Bortezomib ist in Deutschland, Österreich und der Schweiz unter dem Namen Velcade im Handel erhältlich.
Literatur
[Bearbeiten | Quelltext bearbeiten]- P. G. Richardson u. a.: Bortezomib or High-Dose Dexamethasone for Relapsed Multiple Myeloma. In: NEJM. 352, 2005, S. 2546–2549. PMID 15958804
- P. G. Richardson u. a.: Bortezomib in the front-line treatment of multiple myeloma. In: Expert Rev Anticancer Ther. 8, 2008, S. 1053–1072. PMID 18588451
- P. G. Richardson u. a.: Extended follow-up of a phase 3 trial in relapsed multiple myeloma: final time-to-event results of the APEX trial. In: Blood. 110(10), 15. Nov 2007, S. 3557–3560. Epub 2007 Aug 9. PMID 17690257
- J. F. San Miguel u. a.: Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. In: N Engl J Med. 359(9), 28. Aug 2008, S. 906–917. doi:10.1056/NEJMoa0801479. PMID 18753647
- J. F. San Miguel u. a.: Persistent overall survival benefit and no increased risk of second malignancies with bortezomib-melphalan-prednisone versus melphalan-prednisone in patients with previously untreated multiple myeloma. In: Journal of Clinical Oncology. Band 31, Nummer 4, Februar 2013, S. 448–455, doi:10.1200/JCO.2012.41.6180, PMID 23233713.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Bortezomib bei der Food and Drugs Administration
- Bortezomib bei MEROPS
- Velcade bei der European Medicines Agency
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Bortezomib bei Alfa Aesar, abgerufen am 29. Mai 2022 (Seite nicht mehr abrufbar).
- ↑ a b c d myelom.at: Velcade® - Wirkstoff Bortezomib. ( vom 8. August 2007 im Internet Archive) Abgerufen am 27. Juni 2007.
- ↑ Medknowledge.de: Bortezomib (Velcade®) für Multiples Myelom (Plasmozytom) zugelassen. ( vom 5. September 2007 im Internet Archive) Abgerufen am 27. Juni 2007.
- ↑ Velcade / Bortezomib (PDF; 89 kB). EMA (CHMP), Zusammenfassung des EPAR für die Öffentlichkeit, abgerufen am 20. Februar 2013.
- ↑ ema.europa.eu: Velcade® - Wirkstoff Bortezomib. (PDF; 310 kB). Abgerufen am 3. Januar 2013.
- ↑ Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Multiple drug combinations of bortezomib, lenalidomide, and thalidomide for first-line treatment in adults with transplant-ineligible multiple myeloma: a network meta-analysis. In: Cochrane Database of Systematic Reviews. 25. November 2019, doi:10.1002/14651858.CD013487.
- ↑ a b ÖAZ aktuell: Bortezomib. ( vom 20. Februar 2007 im Internet Archive) Abgerufen am 27. Juni 2007.
- ↑ a b Neue Arzneistoffe - Bortezomib. In: Pharmazeutische Zeitung. abgerufen am 27. Juni 2007.
- ↑ P. Bonvini, E. Zorzi, G. Basso, A. Rosolen: Bortezomib-mediated 26S proteasome inhibition causes cell-cycle arrest and induces apoptosis in CD-30+ anaplastic large cell lymphoma Leukemia 2007, Band 21, Ausgabe 4, Seiten 838–42, PMID 17268529, doi:10.1038/sj.leu.2404528.
- ↑ P. G. Richardson, H. Briemberg, S. Jagannath, P. Y. Wen, B. Barlogie, J. Berenson, S. Singhal, D. S. Siegel, D. Irwin, M. Schuster, G. Srkalovic, R. Alexanian, S. V. Rajkumar, S. Limentani, M. Alsina, R. Z. Orlowski, K. Najarian, D. Esseltine, K. C. Anderson, A. A. Amato: Frequency, Characteristics, and Reversibility of Peripheral Neuropathy During Treatment of Advanced Multiple Myeloma With Bortezomib. In: Journal of Clinical Oncology. 24, 2006, S. 3113–3120, PMID 16754936.
- ↑ P. Moreau, H. Pylypenko, S. Grosicki, I. Karamanesht, X. Leleu, M. Grishunina, G. Rekhtman, Z. Masliak, T. Robak, A. Shubina, B. Arnulf, M. Kropff, J. Cavet, D. L. Esseltine, H. Feng, S. Girgis, H. van de Velde, W. Deraedt, J. L. Harousseau: Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: a randomised, phase 3, non-inferiority study. In: Lancet Oncol. 12(5), 2011, S. 431–440, doi:10.1016/S1470-2045(11)70081-X, PMID 21507715.
- ↑ NICE: Krebsmedikament soll nur bezahlt werden, wenn es wirkt. ( vom 17. März 2016 im Internet Archive) In: aerzteblatt.de, 5. Juni 2007, abgerufen am 7. Mai 2010.