Aciclovir
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
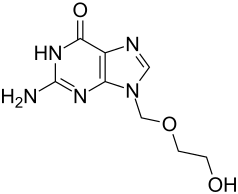
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Aciclovir[1] | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 225,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
256,5–257 °C[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Aciclovir ist ein Arzneistoff aus der Gruppe der Virostatika. Er wird zur Behandlung von Infektionskrankheiten durch bestimmte Viren aus der Familie der Herpesviren verwendet.
Chemisch ist Aciclovir ein Derivat der Nukleinbase Guanin, die als Bestandteil der DNA und RNA vorkommt.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Für Aciclovir sind verschiedene Synthesevarianten beschrieben.[7] Alle Varianten gehen vom Guanin aus, wobei im ersten Schritt Schutzgruppen mittels Acetanhydrid in DMF als Lösungsmittel eingeführt werden. Das Strukturelement der Hydroxyethoxymethylgruppen kann durch die Reaktion von 1,3-Dioxolan mit Acetanhydrid erzeugt werden.[8] Der resultierende 2-Acetoxyethylacetoxymethylether[9] wird dann mit dem zweifach acetylierten Guanin umgesetzt. Nach einer basischen Entfernung der Schutzgruppen wird die Zielverbindung erhalten.
Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Aciclovir wird bei Infektionen mit Herpes-simplex-Viren, wie z. B. Herpes der Geschlechtsteile (Herpes genitalis), Herpes des Neugeborenen (Herpes neonatorum) und durch Herpes-simplex-Viren verursachte Hirnentzündung (Herpes-simplex-Enzephalitis) verwendet, ebenso bei Infektionen mit Varizella-Zoster-Viren wie der Gürtelrose (Herpes zoster).
Bei einem geschwächten Immunsystem (angeborene oder erworbene Immundefizienz) ist Aciclovir ferner angezeigt zur Behandlung der Windpocken (Varizellen) und von durch Herpes-simplex-Viren verursachten Infektionen der Haut und Schleimhäute. Zur Vorbeugung vor Herpes-simplex-Infektionen während einer immunsuppressiven Therapie nach Organtransplantationen oder während einer Strahlentherapie ist Aciclovir ebenfalls angezeigt. In hoher Dosierung ist Aciclovir in Deutschland außerdem zur Prophylaxe gegen das Cytomegalievirus (CMV) nach Organtransplantationen zugelassen. Bestimmte Studien deuten darauf hin, dass Aciclovir für diesen Einsatzbereich effektiv sein könnte.[10][11] Es ist jedoch zur generellen Behandlung von CMV nicht etabliert und auch zur Prophylaxe nach Organtransplantationen nicht Therapieoption der ersten Wahl. In medizinischen Standardwerken wird hierfür in der Regel der Wirkstoff Ganciclovir empfohlen.[12]
Aciclovir wird als Tablette oder Suspension eingenommen oder auch, insbesondere bei schwerem Krankheitsverlauf, intravenös verabreicht. Wichtig ist der Therapiebeginn möglichst früh im Krankheitsverlauf und eine regelmäßige Gabe, die ein Zeitintervall von 6 Stunden nicht überschreitet.
Äußerlich wird Aciclovir in Cremes bei Lippenherpes (Herpes labialis) und Herpes genitalis, in Augensalben bei Herpes-simplex-Infektionen der Hornhaut (Herpes corneae) verwendet.
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wirkungsweise
[Bearbeiten | Quelltext bearbeiten]Aciclovir ist ein sogenannter Antimetabolit und hemmt in seiner aktiven (phosphorylierten) Form den Stoffwechsel der Zelle. Das Besondere an Aciclovir ist, dass es nur in infizierten Zellen aktiviert wird. Es wirkt also nur da, wo es auch gebraucht wird, um das Virus an der Replikation zu hindern. Um sich zu vermehren, bringen Herpesviren eine Reihe von eigenen Enzymen mit in die Zelle. Zu diesen Enzymen gehört z. B. die virale Thymidinkinase. Die eigentliche Aufgabe der Thymidinkinase bei der Virusreplikation ist es, eine Phosphatgruppe an das zelleigene Thymidin zu heften. Das so aktivierte Thymidin wird dann von der DNA-Polymerase der befallenen Zelle verwendet, um unter anderem auch die Virus-DNA aufzubauen. Hier setzt das Aciclovir an: Die virale Thymidinkinase der Alphaherpesvirinae erkennt Aciclovir als Thymidin und aktiviert es, obwohl die aktivierte Form von Aciclovir für die DNA-Synthese unbrauchbar ist. So kommt es zum Kettenabbruch, und die Virusvermehrung wird gestoppt.[13][14]
Aciclovir wird nur durch die virale Thymidinkinase in die Monophosphatform überführt. Dabei wirkt die virale Thymidinkinase weit (3000 Mal) effizienter bei der Phosphorylierung als die zelluläre Thymidinkinase. Anschließend wird die Monophosphatform durch die zelluläre Kinase in die aktive Triphosphatform, Acyclo-GTP, weiterphosphoryliert.[15] Wird Acyclo-GTP anstelle von GTP durch die DNA-Polymerase der befallenen Zelle zur DNA-Replikation verwendet, so führt dies unweigerlich zum Abbruch der DNA-Synthese, da beim Acyclo-GTP keine 3'-OH-Gruppe vorhanden ist, an die ein folgendes Desoxynucleosid-Triphosphat (dNTP) angeknüpft werden könnte.
Acyclo-GTP hat eine ungefähr 100-mal höhere Affinität zur viralen DNA-Polymerase als zur zellulären DNA-Polymerase. Die Monophosphatform des Aciclovirs wird deshalb auch in die virale DNA eingebaut, was bei der viralen DNA-Synthese daher ebenfalls zum Kettenabbruch führt. Es wurde nachgewiesen, dass virale Enzyme Acyclo-GMP nicht aus der Kette entfernen können, was zur nachhaltigen Hemmung der DNA-Polymerase führt. Acyclo-GTP wird in der Zelle recht schnell metabolisiert, möglicherweise durch zelluläre Phosphatasen.
Das Epstein-Barr-Virus produziert nicht die gleiche virale Thymidinkinase wie die Herpes-simplex-Viren und das Varizella-Zoster-Virus. Aus diesem Grunde können Epstein-Barr-Virus-infizierte Zellen Aciclovir nicht in seine pharmakologisch aktive Triphosphat-Form überführen. Bei diesem Mitglied der Familie der Herpesviren ist Aciclovir daher unwirksam.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Der Einsatz von Aciclovir wird teilweise eingeschränkt durch die geringe Wasserlöslichkeit und die geringe Resorption bei oraler Verabreichung, die zu einer Bioverfügbarkeit von unter 50 % führt.[16] Bei oraler Verabreichung wird die Spitzenkonzentration im Serum nach 1–2 Stunden erreicht. Große Dosen müssen daher intravenös verabreicht werden. Aciclovir liegt im Blut zum großen Teil in freier Form vor; nur 30 % sind an Plasmaproteine gebunden. Die Plasmahalbwertszeit des Aciclovirs beträgt ungefähr 3 Stunden.[16][14]
Die Ausscheidung von Aciclovir findet über die Niere statt, teils durch glomeruläre Filtration, teils durch tubuläre Sekretion. Es sind Nierenprobleme bekannt geworden bei großen, schnell und intravenös verabreichten Dosen, weil dann Aciclovir in den Nieren auskristallisieren kann.[17]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Da Aciclovir auch in die zelluläre DNA eingebaut werden kann, stellt es ein chromosomales Mutagen dar. Daher sollte es nicht während der Schwangerschaft verwendet werden. Trotzdem konnte bisher weder ein teratogener noch ein karzinogener Effekt nachgewiesen werden. Die akute Giftigkeit (LD50) von Aciclovir bei oraler Verabreichung liegt über 1 g/kg, dies wegen der geringen Absorption im Magen-Darm-Trakt. In Einzelfällen haben irrtümlich verabreichte, extrem hohe (bis zu 80 mg/kg) intravenöse Dosen keinerlei Nebenwirkung gezeigt. Die häufigsten Nebenwirkungen sind Kopfschmerzen, Schwindelgefühl und Beschwerden des Verdauungstraktes nach oraler und intravenöser Verabreichung sowie stechende und brennende Empfindungen bei äußerlicher Anwendung.[18][19] Gegen Aciclovir entwickeln sich zwar recht schnell Resistenzen, aber das beschränkt den klinischen Einsatz kaum: So wurde in einer US-amerikanischen Studie von 2002 eine Resistenzrate von 0,2 % der Lippenherpes-Viren gefunden,[20] obwohl Aciclovir seit 20 Jahren immer öfter eingesetzt wird.[21]
Hohe Konzentrationen von CMMG (9-Carboxymethoxymethylguanin), dem Stoffwechselprodukt von Aciclovir, werden mit dem Cotard-Syndrom in Verbindung gebracht. Dabei handelt es sich um ein Krankheitsbild, bei dem die betroffene Person irrig davon überzeugt ist, dass sie tot sei, nicht existiere, glaube zu verwesen oder ihr Blut sowie innere Organe verloren zu haben. Bei Patienten mit eingeschränkter Nierenfunktion scheint dieses Risiko auch nach Herabsetzung der Dosis zu bestehen. Im zitierten Fall kurierte eine Dialyse das Cotard-Syndrom innerhalb weniger Stunden.[22]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Aciclovir wurde 1974 von Howard Schaeffer und Gertrude B. Elion bei Burroughs Wellcome & Company entwickelt, auf Basis von in einem Screening-Verfahren entdeckten Nukleosiden aus einem karibischen Schwamm (Cryptothetia crypta). Die Suche nach Mitteln gegen Komponenten von RNA- und DNA-Viren begann bei Wellcome Anfang der 1960er Jahre, und man war speziell auf der Suche nach Inhibitoren von Adenosin-Desaminase. 1977 begannen klinische Tests, 1979 wurde ein Patent erteilt (mit Schaeffer als eingetragenem Erfinder), und eine erste Version wurde 1982 ausgeliefert.[23] Veröffentlichungen dazu von den Entwicklern erschienen ab 1977.[24][25][26][27]
Strukturvariante
[Bearbeiten | Quelltext bearbeiten]Durch Veresterung mit der Aminosäure L-Valin entsteht das besser resorbierbare Valaciclovir, das als Prodrug fungiert.
Verkaufsabgrenzung
[Bearbeiten | Quelltext bearbeiten]Ohne ärztliche Verordnung ist Aciclovir in Apotheken in Deutschland und Österreich nur als fünfprozentige Creme oder Salbe in Packungsgrößen bis zu 2 g ausschließlich zur Behandlung des Lippenherpes erhältlich. In der Schweiz sind diese Präparate zur Behandlung von Lippenherpes in der Abgabekategorie D, d. h., sie können nach Fachberatung in Apotheken und Drogerien bezogen werden.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Accarix (A), ACERPES (D), (D), Acic (D), Aciclostad (D), Acivir (CH), Acyclovir (CH), Aviral (CH), Avirox (Malaysia), DYNEXAN Herpescreme (D), Helvevir (CH), HerpoMed (A), Nycovir (A), Supraviran (D), ViroMed (A), Virucalm (CH), Virupos (D), Virzin (D), Xorox (A), Zoliparin (D), Zovirax (D, A, CH) als Tabletten, Suspensionen, Infusionslösungskonzentrat, Augensalben und 5 %-Creme; zahlreiche Generika (D, A, CH)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Aciclovir – ein neues Virustatikum. Zeitschrift für Chemotherapie, 1983 (mit Ergänzungen August 2008).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b INN Recommended List 20. In: who.int. 8. Oktober 1980, abgerufen am 6. Oktober 2024 (englisch).
- ↑ a b F. von Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Band 7: Stoffe A–D. 5. Auflage. Birkhäuser / Springer, 1991, ISBN 3-540-52688-9, S. 44.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 698.
- ↑ a b c Europäisches Arzneibuch 6.2
- ↑ a b c d Arzneibuch Kommentar. Gesamtwerk einschließlich 36. Aktualisierungslieferung 2010, ISBN 978-3-8047-2461-7.
- ↑ a b Datenblatt Acycloguanosine, ≥99% (HPLC), powder bei Sigma-Aldrich, abgerufen am 21. Dezember 2019 (PDF).
- ↑ a b c d e f g h i j k l m n o A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2.
- ↑ Patent GB 1 523 865 (Wellcome, 26. August 1977).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (2-Acetoxyethoxy)methylacetat: CAS-Nr.: 59278-00-1, EG-Nr.: 261-686-7, ECHA-InfoCard: 100.056.060, PubChem: 100999, ChemSpider: 91248, Wikidata: Q72435585.
- ↑ E. M. Hodson, M. Ladhani, A. C. Webster, G. F. M. Strippoli, J. Craig: Antiviral drugs used as protective and preventive therapy reduce CMV disease and CMV-associated deaths in solid organ transplant recipients. In: Cochrane Database of Systematic Reviews. Februar 2013, S. CD003774.
- ↑ D. S. Owers, A. C. Webster, G. F. M. Strippoli, K. Kable, E. M. Hodson: Pre-emptive treatment for cytomegalovirus viraemia to prevent cytomegalovirus disease in solid organ transplant recipients. In: Cochrane Database of Systematic Reviews. Februar 2013, S. CD005133. doi:10.1002/14651858.CD005133.pub3.
- ↑ B. N. Fields: Fields Virology. 5. Auflage. Band 2, 2007, S. 2750.
- ↑ S. Leflore, P. L. Anderson, C. V. Fletcher: A risk-benefit evaluation of aciclovir for the treatment and prophylaxis of herpes simplex virus infections. In: Drug Safety. Band 23, Nummer 2, August 2000, S. 131–142. PMID 10945375.
- ↑ a b A. J. Wagstaff, D. Faulds, K. L. Goa: Aciclovir. A reappraisal of its antiviral activity, pharmacokinetic properties and therapeutic efficacy. In: Drugs. Band 47, Nummer 1, Januar 1994, S. 153–205. PMID 7510619.
- ↑ J. C. Pottage, H. A. Kessler: Herpes simplex virus resistance to acyclovir: clinical relevance. In: Infectious agents and disease. Band 4, Nummer 3, September 1995, S. 115–124. PMID 8548189.
- ↑ a b G. D. Morse, M. J. Shelton, A. M. O’Donnell: Comparative pharmacokinetics of antiviral nucleoside analogues. In: Clinical Pharmacokinetics. Band 24, Nummer 2, Februar 1993, S. 101–123, doi:10.2165/00003088-199324020-00002. PMID 8453821.
- ↑ A. Schwarz, A. Perez-Canto: Nephrotoxicity of antiinfective drugs. In: International Journal of Clinical Pharmacology and Therapeutics. Band 36, Nummer 3, März 1998, S. 164–167. PMID 9562233.
- ↑ Sicherheitsprofil (topische Anwendung) ( vom 19. Oktober 2015 im Internet Archive) (PDF) Bewertungsbericht vom 24. September 2010 (englisch).
- ↑ Sicherheitsprofil (systemische Anwendung) ( vom 11. Dezember 2015 im Internet Archive) (PDF) Bewertungsbericht vom 24. September 2010 (englisch).
- ↑ Surveillance for antiviral-agent-resistant herpes simplex virus in the general population with recurrent herpes labialis. GlaxoSmithKline Consumer Healthcare. PMID 12183267; Studie zur Resistenz gegen Aciclovir (englisch).
- ↑ Current management and recommendations for access to antiviral therapy of herpes labialis. In: J Clin Virol. 53(1), Januar 2012, S. 6–11, PMC 3423903 (freier Volltext); Arbeit zur Behandlung von Lippenherpes (englisch).
- ↑ Anders Helldén, Ingegerd Odar-Cederlöf, Kajsa Larsson, Ingela Fehrman-Ekholm,Thomas Lindén: Death delusion. In: BMJ. Band 335, Nr. 7633, Dezember 2007, S. 1305–1305, doi:10.1136/bmj.39408.393137.BE, PMID 18156240.
- ↑ Dannie H. King: History, pharmacokinetics, and pharmacology of acyclovir. In: Journal of the American Academy of Dermatolology. Band 18, 1988, S. 176–179. PMID 2828440.
- ↑ G. Elion, T. A. Furman, J. A. Fyfe, P. de Miranda, L. Beauchamp, H. J. Schaeffer: Selectivity of action of an anti-herpetic agent, 9-(2-Hydroxyethoxymethyl) guanine. In: Proc. Nat. Acad. Sci. Band 74, 1977, S. 5716–5720.
- ↑ H. J. Schaeffer, L. Beauchamp, P. de Miranda, G. Elion, D. J. Bauer, P. Collins: 9-(2-Hydroxyethoxymethyl) guanine activity against viruses of the Herpes group. In: Nature. Band 272, 1978, S. 583–585.
- ↑ H. J. Schaeffer Acyclovir chemistry and spectrum of activity. In: Am. J. Med. 73, 1982, S. 4–6.
- ↑ G. Elion: Mechanism of action and selectivity of Acyclovir. In: Am. J. Med. 73, 1982, S. 7–13.
