Ösophagusvarizen

| Klassifikation nach ICD-10 | |
|---|---|
| I85 | Ösophagusvarizen |
| ICD-10 online (WHO-Version 2019) | |
Ösophagusvarizen sind Krampfadern (Varizen) der Speiseröhre (Ösophagus). Diese Erweiterungen der Venengeflechte in der Wand der Speiseröhre sind Folge einer Störung der venösen Blutzirkulation und meist durch ein unter Überdruck stehendes Pfortadersystem (portale Hypertension), beispielsweise als Folge einer Leberzirrhose, bedingt. Blutungen aus Speiseröhrenkrampfadern sind eine lebensbedrohliche Komplikation und ein medizinischer Notfall.

Ursachen
[Bearbeiten | Quelltext bearbeiten]Das nährstoffreiche, aber sauerstoffarme venöse Blut von Milz, Magen, Darm und Gallenblase fließt normalerweise über die Pfortader (Vena portae) durch die Leber und von dort in die untere Hohlvene. Ist dieser Blutabfluss eingeschränkt (z. B. durch eine Leberzirrhose), entsteht eine portale Hypertension (erhöhter Blutdruck in der Pfortader). In diesem Fall wird die Leber über die portokavalen Anastomosen (Verbindungen zwischen Pfortader und oberer und unterer Hohlvene) umgangen, das Blut fließt dann direkt in die Hohlvenen.
Es gibt mehrere solcher portokavaler Anastomosen: im Rektum, in der Bauchwand, im Magen und in der Speiseröhre. Letztere erweitern sich beim erhöhten Blutdruck in der Pfortader zu Ösophagusvarizen. Blutungen aus diesen Varizen können lebensgefährlich sein.
Epidemiologie (Häufigkeit)
[Bearbeiten | Quelltext bearbeiten]Bei schwergradiger portaler Hypertension, beispielsweise im Rahmen einer Leberzirrhose, weisen etwa die Hälfte der Betroffenen Ösophagusvarizen auf. Die Letalität einer Blutung beträgt auch bei Behandlung bis zu 30 %. Die Wahrscheinlichkeit, dass auf eine erste Ösophagusvarizenblutung ein Rezidiv erfolgt, liegt bei etwa 70 %.
Komplikationen
[Bearbeiten | Quelltext bearbeiten]Die erweiterten Venen im unteren Ende der Speiseröhre, eben die Ösophagusvarizen, können, da sie sehr dünnwandig sind, leicht einreißen und zu heftigen Blutungen führen. Der Blutverlust führt, sofern stark genug, zum Schock und kann lebensbedrohlich werden. Diese Blutungen werden oft durch eine bestehende Blutgerinnungsstörung, die durch die Leberzirrhose verursacht ist, kompliziert. Leichte Blutungen führen zu Teerstuhl (Meläna), bei akut lebensbedrohlichen Blutungen kommt typischerweise Erbrechen von Blut (Hämatemesis) dazu. Außerdem können beim Patienten mit Leberzirrhose unabhängig von Blutungen weitere Komplikationen wie Aszites und Leberkoma auftreten. Eine Studie zeigte, dass die Therapie der hepatischen Enzephalopathie auch das Risiko für andere Leberzirrhose-Komplikationen wie spontan bakterielle Peritonitis (SBP) oder Varizenblutungen senken kann.[1]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die Diagnose wird endoskopisch per Gastroskopie gestellt. Im Rahmen einer Gastroskopie kann auch, sofern eine Blutung besteht, ein Versuch der Blutstillung unternommen werden. Die Gastroskopie dient vor allem auch zur Beantwortung der Frage, ob andere Blutungsquellen bestehen. Klinisch bedeutsam sind Ösophagusvarizen nämlich in allererster Linie als Blutungsquelle. Als weitere Blutungsquellen im Magen oder in der Speiseröhre kommen das Mallory-Weiss-Syndrom, Ulkusblutungen und Magenschleimhauterosionen in Frage.
Stadieneinteilung
[Bearbeiten | Quelltext bearbeiten]Nach Aussehen und Eigenschaften während der Endoskopie kann eine klinische Stadieneinteilung in Grad I - IV erfolgen:
- Stadium I: Es liegen Erweiterungen der submukösen Venen vor, die jedoch nach Luftinsufflation durch das Endoskop verstreichen.
- Stadium II: Es bestehen einzelne in das Lumen des Ösophagus hervorragende Varizen, die auch bei Luftinsufflation bestehen bleiben.
- Stadium III: Das Lumen des Ösophagus ist durch hervorragende Varizenstränge eingeengt. Als Zeichen einer Epithelschädigung (Erosion) können rötliche Flecken ("cherry spots") auf der Schleimhaut bestehen.
- Stadium IV: Die Varizenstränge haben das Ösophaguslumen verlegt, es bestehen in der Regel zahlreiche Erosionen der Schleimhaut.
Bei einem Teil der Patienten liegen neben Ösophagusvarizen auch Magenvarizen und eine Gastropathia hypertensiva vor.
Therapie
[Bearbeiten | Quelltext bearbeiten]Bei der Therapie ist zwischen akuten Maßnahmen bei aufgetretener Blutung und einer Blutungsprophylaxe bzw. einer Rezidivprophylaxe zu unterscheiden.
Therapie der akuten Blutung
[Bearbeiten | Quelltext bearbeiten]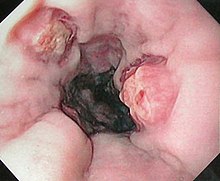
Primäres Ziel ist die Blutstillung. Hierzu entwickelte Karl Vossschulte bis 1957 eine Dissektionsligatur.[2] Die Blutstillung kann am besten durch eine Gummibandligatur der blutenden Varizen, Injektion von Histoacryl (N-Butylcyanacrylat) oder Varizenverödung mittels Unterspritzung mit sklerosierenden Substanzen (seit den 1940er Jahren, etwa von C. Crawford und I. Boerema angewandt)[3] erreicht werden.
Ist eine endoskopische Varizenbehandlung nicht möglich, sollte eine Ballonsonde als Ballontamponade wie sie von Urclay 1893 erforscht und von Karl Westphal 1930 zur Blutstillung bei Varizenblutungen empfohlen wurde, mittels Kompression eingesetzt werden, z. B. die bei dem von Sengstaken 1950 publizierten Verfahren entwickelte Ballonsonde,[4] später Sengstaken-Blakemore-Sonde genannt, oder die Linton-Nachlas-Sonde. Danach sollte der Patient schnellstmöglich zur endoskopischen Therapie weiterverlegt werden. Bis zur Sklerosierung oder bei Tamponade durch Sonden kann der portalvenöse Blutfluss durch die Gabe von Terlipressin oder (off-label) Somatostatin bzw. Octreotid gesenkt werden.[5]
Weitere allgemeine Maßnahmen sind:
- Monitoring der Vitalfunktionen
- Endotracheale Intubation (Aspirationsgefahr)
- Volumengabe über großlumige peripher-venöse Zugänge
- Gabe von Antibiotika (drohende Sepsis)
- Management der Grunderkrankung (z. B. bei Leberzirrhose)
Therapie zur Rezidiv- bzw. Blutungsprophylaxe
[Bearbeiten | Quelltext bearbeiten]Als kausale Therapie ist die zugrundeliegende Ursache der portalen Hypertension zu therapieren und damit den übermäßigen Zustrom von Blut aus dem Pfortadersystem zu verhindern. Es sind jedoch nicht alle Ursachen der portalen Hypertonie therapierbar, so dass häufig lediglich eine symptomatische und hinauszögernde Therapie im blutungsfreien Intervall erfolgt.
Die medikamentöse Therapie umfasst die Gabe von Betablockern, Nitraten und Spironolacton zur Drucksenkung im Portalkreislauf. Die Ligaturbehandlung ist die Methode der Wahl, da selten schwerwiegende Komplikationen auftreten.
Interventionelle und operative Verfahren zielen in der Regel auf die Schaffung eines Shunts zwischen Pfortaderkreislauf und dem systemisch-venösen Kreislauf als künstliche portokavale Anastomose, wie sie erstmals 1877 von N. V. Eck als Eck’sche Fistel angegeben wurde.[6] Da die Leber dabei umgangen wird und so ihre Fähigkeit verliert, Giftstoffe wie bspw. Ammoniak zu verstoffwechseln, erhöhen Shunts häufig die Wahrscheinlichkeit für das Auftreten weiterer Komplikationen der Leberzirrhose, wie einer portalen Hypertension oder hepatischen Enzephalopathie.[7] Auch Methoden zur Verminderung des Blutvolumens im Pfortadersystem wurden entwickelt, etwa durch Splenektomie (durch Banti 1874) oder durch Ligatur von Arterien (etwa der Arteria gastrica sinistra, der Arteria gastroepiploica, der Milzarterie oder der Arteria hepatica) sowie durch Bewirkung der Bildung zusätzlicher Kollateralen zwischen Pfortader- und Kava-Kreislauf (mittels Omentopexie erstmals 1898 durch Sape Talma).[8] Gängige Verfahren sind heute:
- TIPS (Transjugulärer intrahepatischer portosystemischer Shunt)
- Shuntoperationen:
- Portokavaler Shunt (Portokavale End-zu-Seit-Anastomose, PCA)
- Splenorenaler Shunt
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ S. H. Kang et al. in Aliment Pharmacol Ther. Band 26, 2017, S. 845–855.
- ↑ Rudolf Nissen: Zum Geleit. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Zum 65. Geburtstag von Prof. Dr. K. Vossschulte, Direktor der Chirurgischen Universitätsklinik und Poliklinik Gießen. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. XI–XIII, hier: S. XII.
- ↑ Friedrich Wilhelm Gierhake: Speiseröhre. 1973, S. 189.
- ↑ Friedrich Wilhelm Gierhake: Speiseröhre. 1973, S. 189.
- ↑ Gerd Herold: Innere Medizin. 2016, S. 559.
- ↑ Friedrich Wilhelm Gierhake: Speiseröhre. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Mit einem Geleitwort von Rudolf Nissen. Dustri-Verlag Dr. Karl Feistle, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 186–191, hier: S. 189.
- ↑ K. Grüngreiff: Thieme Refresher Innere Medizin. 2014; 1: R1-R16.
- ↑ Friedrich Wilhelm Gierhake: Speiseröhre. 1973, S. 189.