2-Chlorpropansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Chlorpropansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblos bis gelbliche fast geruchlose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,52 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,26 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−12 °C[1] | ||||||||||||||||||
| Siedepunkt |
186 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
2,8[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4380 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−522,5 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Chlorpropansäure (Trivialname 2-Chlorpropionsäure) ist eine organisch-chemische Verbindung aus der Stoffgruppe der chlorierten Carbonsäuren.
Isomerie
[Bearbeiten | Quelltext bearbeiten]2-Chlorpropansäure ist eine chirale Verbindung mit einem Stereozentrum am C2-Atom. Folglich existieren die zwei enantiomeren Formen (R)-2-Chlorpropansäure und (S)-2-Chlorpropansäure. Wenn in diesem Text oder in der wissenschaftlichen Literatur „2-Chlorpropansäure“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist racemische 2-Chlorpropansäure [Synonyme: DL-2-Chlorpropansäure , (±)-2-Chlorpropansäure und (RS)-2-Chlorpropansäure ] gemeint, also ein 1:1-Gemisch der beiden Enantiomeren.
| Stereoisomere von 2-Chlorpropansäure | ||
| Name | (R)-2-Chlorpropansäure | (S)-2-Chlorpropansäure |
| Andere Namen | D-(+)-2-Chlorpropansäure | L-(–)-2-Chlorpropansäure |
| Strukturformel |  |

|
| CAS-Nummer | 7474-05-7 | 29617-66-1 |
| 598-78-7 (unspez.) | ||
| PubChem | 2724540 | 107915 |
| 11734 (unspez.) | ||
| Wikidata | Q27277689 | Q27144279 |
| Q209361 (unspez.) | ||
Neben den beiden Stereoisomeren existiert auch das Positionsisomer 3-Chlorpropansäure.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die technische Herstellung racemischer 2-Chlorpropansäure erfolgt durch Umsetzung von Propionsäure mit gasförmigen Chlor bei Temperaturen von 110–120 °C in Gegenwart von Phosphortrichlorid (PCl3), Dischwefeldichlorid (S2Cl2), Thionylchlorid (SOCl2), Chlorsulfonsäure (ClSO3H) oder Propionylchlorid.[7]
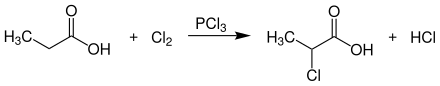
In einem verbesserten Verfahren wird die Chlorierung von Propionsäure in Gegenwart von Propionsäureanhydrid als Katalysator unter Ausschluss von Licht und Radikalbildnern bei 125–135 °C durchgeführt.[8]
Das L-Enantiomer wird aus D-Milchsäure und Thionylchlorid hergestellt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Chlorpropansäure ist eine farblose bis gelbliche, fast geruchlose Flüssigkeit. Oberhalb von 60 °C beginnt sie sich zu zersetzen, wobei Chlorwasserstoff, Kohlenstoffmonoxid und Kohlenstoffdioxid entstehen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]2-Chlorpropansäure wird zur Herstellung von Farbstoffen, Arzneimitteln und Herbiziden verwendet.[1] Die Phenoxypropionsäurederivate wie Clodinafop, Fenoxaprop, Fluazifop, Haloxyfop, Isoxapyrifop, Quizalofop sowie die Phenoxycarbonsäuren Dichlorprop, Fenoprop, Flamprop, Mecoprop und das Acetylalanin Benalaxyl werden ausgehend von 2-Chlorpropansäure dargestellt.[9]
Die Reduktion von (S)-2-Chlorpropansäure mit Lithiumaluminiumhydrid ergibt (S)-2-Chlorpropanol, den einfachsten Chloralkohol, welcher mit Kaliumhydroxid weiter zu (R)-Methyloxiran reagiert.[10]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu 2-Chlorpropionsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Bernd Engels, Carsten Schmuck, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner. Pearson Deutschland GmbH, 2008, ISBN 3-8273-7286-0, S. 553 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Toxikologische Bewertung von α-Chlorpropionsäure und Natrium-α-Chlorpropionat (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-112.
- ↑ Eintrag zu 2-chloropropionic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ Ulf-Rainer Samel, Walter Kohler, Armin Otto Gamer, Ullrich Keuser, Shang-Tian Yang, Ying Jin, Meng Lin, Zhongqiang Wang, Joaquim Henrique Teles: Propionic Acid and Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 31. Januar 2018, doi:10.1002/14356007.a22_223.pub4.
- ↑ Patent DE3422672A1: Verfahren zur Herstellung von 2-Chlorpropansäure. Angemeldet am 19. Juni 1984, veröffentlicht am 19. Dezember 1985, Anmelder: Hoechst AG, Erfinder: Franz Landauer.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 1030 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Koppenhoefer, B. und Schurig, V.: (R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane In: Organic Syntheses. 66, 1988, S. 160, doi:10.15227/orgsyn.066.0160; Coll. Vol. 8, 1993, S. 434 (PDF).

