1,1-Diphenylethylen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
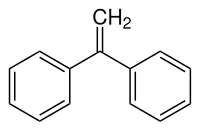
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,1-Diphenylethylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H12 | |||||||||||||||
| Kurzbeschreibung |
hellgelbe geruchlose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,023 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
270–271 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,6065 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,1-Diphenylethylen ist eine chemische Verbindung aus der Gruppe der aromatischen Kohlenwasserstoffe.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]1,1-Diphenylethylen kann durch eine Grignard-Reaktion von Acetophenon mit Phenylmagnesiumbromid, gefolgt von einer säurekatalysierten Dehydratisierungsreaktion gewonnen werden.[3]
1953 entdeckten Georg Wittig und Geissler, dass die Reaktion von Benzophenon mit Methylentriphenylphosphoran die Verbindungen 1,1-Diphenylethylen und Triphenylphosphinoxid in nahezu quantitativer Ausbeute ergibt.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,1-Diphenylethylen ist eine Flüssigkeit, die mischbar mit Methanol, Chloroform und Diethylether, aber praktisch unlöslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]1,1-Diphenylethylen wird als Zwischenprodukt in der organischen Synthese (zum Beispiel von 2-Chlor-1,1-diphenylethen[S 1] und Arzneistoffen) verwendet.[1] Es wirkt bereits in Spuren hemmend auf die Polymerisation einiger Verbindungen wie zum Beispiel Styren.[5][6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j Datenblatt 1,1-Diphenylethylene, 98% bei Alfa Aesar, abgerufen am 21. November 2022 (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt 1,1-Diphenyl-ethylen, 97% bei Sigma-Aldrich, abgerufen am 21. November 2022 (PDF).
- ↑ Lisa T. Alty, Marcia B. France, Isaac G. Alty, Christine A. Saber, Donna M. Smith: Synthesis of 1,1-Diphenylethylene (DPE): The Marriage of a Grignard Reaction and a Column Chromatography Experiment. In: Journal of Chemical Education. Band 93, Nr. 1, 2016, S. 206–209, doi:10.1021/acs.jchemed.5b00212.
- ↑ Adalbert Maercker: Organic Reactions. John Wiley & Sons, Inc., Hoboken, NJ, USA 2011, ISBN 978-0-471-26418-7, The Wittig Reaction, S. 270–490, doi:10.1002/0471264180.or014.03.
- ↑ Sebastian Koltzenburg, Michael Maskos, Oskar Nuyken: Polymere: Synthese, Eigenschaften und Anwendungen. Springer Berlin Heidelberg, 2013, S. 256 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Roderic P. Quirk, Taejun Yoo, Youngjoon Lee, Jungahn Kim, Bumjae Lee: Biopolymers · PVA Hydrogels, Anionic Polymerisation Nanocomposites. Springer, Berlin, Heidelberg 2000, ISBN 3-540-46414-X, Applications of 1,1-Diphenylethylene Chemistry in Anionic Synthesis of Polymers with Controlled Structures, S. 67–162, doi:10.1007/3-540-46414-x_3.
