Hexachlorcyclohexan
Hexachlorcyclohexan, genauer 1,2,3,4,5,6-Hexachlorcyclohexan, ist der Name eines Gemischs von verschiedenen stereoisomeren chemischen Verbindungen aus der Gruppe der Halogenkohlenwasserstoffe.
Überblick
[Bearbeiten | Quelltext bearbeiten]Die verbreitetste Verbindung ist dabei γ-Hexachlorcyclohexan, welches als Insektizid eingesetzt wird und unter dem Namen Lindan besser bekannt ist. Die anderen isomeren chemischen Verbindungen sind α-Hexachlorcyclohexan, β-Hexachlorcyclohexan und δ-Hexachlorcyclohexan. Daneben gibt es in geringer Menge noch ε-Hexachlorcyclohexan. Die η-, θ- und ζ-Isomere wurden nur im Labor synthetisiert.[1] Da die früher durch den Herstellungsprozess (aus Benzol, das unter UV-Strahlung chloriert wird, wobei fünf der acht möglichen Isomere entstehen) mit vorhandenen und mit ausgebrachten α-, β-, δ- und ε-Isomere sich als geschmacksverändernd, toxischer, als Insektizid weniger wirksam und noch schwerer abbaubar erwiesen, als die ebenfalls nicht unproblematische γ-Struktur (die im technischen Hexachlorcyclohexan nur zu 9–18 % enthalten ist),[2] wurde später nur isomerenreines γ-Hexachlorcyclohexan als Fraß- und Kontaktgift eingesetzt. Lindan (also γ-Hexachlorcyclohexan) wurde erstmals 1825 durch Michael Faraday hergestellt.[3][4] Bei der thermischen Zersetzung bilden sich unter anderem Phosgen und Chlorwasserstoff. α-Hexachlorcyclohexan kommt als einziges 1,2,3,4,5,6-Hexachlorcyclohexan in zwei enantiomeren Formen vor: (+)-α-Hexachlorcyclohexan und (−)-α-Hexachlorcyclohexan. Im Insektizid findet man herstellungsbedingt α-Hexachlorcyclohexan als Racemat [1:1-Gemisch aus (+)-α-HCH und (−)-α-HCH]. In der Leber von wild lebenden Rehen fand man jedoch vornehmlich (−)-α-HCH, die Abbaugeschwindigkeit von (+)-α-HCH ist signifikant höher als die von (−)-α-HCH. Der Abbau erfolgt also enantioselektiv.[5]
α-, β- und γ-Hexachlorcyclohexan wurden in den Anhang A des Stockholmer Übereinkommens aufgenommen.[6] Zudem ist Hexachlorcyclohexan als „prioritärer gefährlicher Stoff“ in Anhang X der europäischen Richtlinie 2000/60/EG (Wasserrahmenrichtlinie) aufgeführt.[7]
Eigenschaften
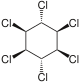
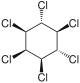
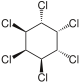
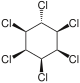
[Bearbeiten | Quelltext bearbeiten]| 1,2,3,4,5,6-Hexachlorcyclohexane | ||||||||||||
| Name | (−)-α-Hexachlorcyclohexan | (+)-α-Hexachlorcyclohexan | β-Hexachlorcyclohexan | γ-Hexachlorcyclohexan (Lindan) | δ-Hexachlorcyclohexan | ε-Hexachlorcyclohexan | ζ-Hexachlorcyclohexan | η-Hexachlorcyclohexan | θ-Hexachlorcyclohexan | |||
| Strukturformel |  |
 |
 |
 |
 |
 |
 |
 |
| |||
| räumliche Struktur |  |
 |
 |
 |
 |
 |
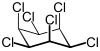 |
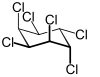 |

| |||
| CAS-Nummer | 608-73-1 (Isomerengemisch) | |||||||||||
| 319-84-6 (Racemat) | 319-85-7 | 58-89-9 | 319-86-8 | 6108-10-7 | 6108-11-8 | 6108-12-9 | 6108-13-0 | |||||
| 119911-70-5 | 119911-69-2 | |||||||||||
| PubChem | 727 | |||||||||||
| Summenformel | C6H6Cl6 | |||||||||||
| Molare Masse | 290,83 g·mol−1 | |||||||||||
| Aggregatzustand | fest | |||||||||||
| Kurzbeschreibung | farbloser bis gelblicher kristalliner Feststoff | |||||||||||
| Schmelzpunkt | 158 °C[8] | 309 °C[9] | 113 °C[10] | 139 °C[11] | 219 °C[12] | |||||||
| Siedepunkt | 288 °C[8] | 323 °C (Zersetzung)[10] | ||||||||||
| Dichte | 1,89 g·cm−3[9] | 1,85 g·cm−3[10] | 1,55 g·cm−3[11] | |||||||||
| Löslichkeit | sehr schwer löslich in Wasser (0,2–8 mg/l)[9][10][11] | |||||||||||
| GHS-Piktogramme[13] |
Gefahr |
|||||||||||
| H- und P-Sätze | H: 301‐312‐351‐410 | |||||||||||
| EUH: keine EUH-Sätze | ||||||||||||
| P: 201‐202‐273‐280‐301+310‐302+352+312[8] | P: 273‐280‐301+310‐501 | |||||||||||
| MAK | Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub)[14] |
|||||||||||
Weblinks
[Bearbeiten | Quelltext bearbeiten]- CDC: HEXACHLOROCYCLOHEXANE (PDF; 0,3 MB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Landesanstalt für Umweltschutz Baden-Württemberg: Stoffbericht Hexachlorcyclohexan (HCH). 1. Auflage, 1993 (pdf, 7,37 MB).
- ↑ Rückstände von Pestiziden im Erdboden (PDF; 978 kB).
- ↑ M. Faraday: Ueber neue Verbindungen von Kohlenstoff und Wasserstoff und über einige andere bei der Zersetzung des Oels durch Hitze erzeugte Substanzen. In: Annalen der Physik. Band 81, Nr. 11, Januar 1825, S. 303–334, doi:10.1002/andp.18250811104.
- ↑ M. Faraday: XXVI. On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat. In: Philosophical Magazine. Band 66, Nr. 329, 30. September 1825, S. 180–197, doi:10.1080/14786442508673946.
- ↑ Bernd Pfaffenberger, Ingo Hardt, Heinrich Hühnerfuss, Wilfried A. König, Gerhard Rimkus, Alexandra Glausch, Volker Schurig, Jürgen Hahn: Enantioselective degradation of α-hexachlorcyclohexane and cyclodiene insecticides in roe-deer liver from different regions in Germany. In: Chemosphere. Band 29, 1994, S. 1543–1554 (englisch).
- ↑ COP4 – Governments unite to step-up reduction on global DDT reliance and add nine new chemicals under international treaty. 9. Mai 2009, abgerufen am 9. März 2021 (englisch).
- ↑ Richtlinie 2000/60/EG des Europäischen Parlaments und des Rates vom 23. Oktober 2000 zur Schaffung eines Ordnungsrahmens für Maßnahmen der Gemeinschaft im Bereich der Wasserpolitik in der konsolidierten Fassung vom 20. November 2014, abgerufen am 4. April 2023. Anhang X Nr. 18.
- ↑ a b c Eintrag zu alpha-1,2,3,4,5,6-Hexachlorcyclohexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Eintrag zu beta-1,2,3,4,5,6-Hexachlorcyclohexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Lindan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b c Eintrag zu delta-1,2,3,4,5,6-Hexachlorcyclohexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ C. R. Ganellin, David J. Triggle: Dictionary of pharmacological agents. ISBN 978-0-412-46630-4 (englisch).
- ↑ Datenblatt BHC (mixture of hexachlorocyclohexanes) bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 58-89-9 bzw. γ-1,2,3,4,5,6-Hexachlorcyclohexan), abgerufen am 7. Januar 2024.
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Chlorcycloalkan
- Cyclohexan
- Persistenter organischer Schadstoff nach Stockholmer Übereinkommen
- Persistenter organischer Schadstoff nach dem Übereinkommen über weiträumige grenzüberschreitende Luftverunreinigung
- Gefährliche Chemikalie nach dem Rotterdamer Übereinkommen


