Tribrombenzole
| Tribrombenzole | |||||||
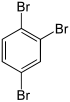
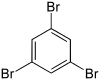
| Name | 1,2,3-Tribrombenzol | 1,2,4-Tribrombenzol | 1,3,5-Tribrombenzol | ||||
| Andere Namen | vic.-Tribrombenzol | asym.-Tribrombenzol | sym.-Tribrombenzol | ||||
| Strukturformel | 
|
|
| ||||
| CAS-Nummer | 608-21-9 | 615-54-3 | 626-39-1 | ||||
| PubChem | 11842 | 12002 | 12279 | ||||
| Summenformel | C6H3Br3 | ||||||
| Molare Masse | 314,80 g·mol−1 | ||||||
| Aggregatzustand | fest | ||||||
| Schmelzpunkt | 87–88 °C[1] | 44,5 °C[2] | 122,8 °C[2] | ||||
| Siedepunkt | 275 °C[2] | 271 °C[2] | |||||
| Löslichkeit | unlöslich in Wasser | ||||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | siehe oben | 315‐319‐335‐410 | 413 | ||||
| siehe oben | keine EUH-Sätze | keine EUH-Sätze | |||||
| siehe oben | 261‐273‐305+351+338‐501 | keine P-Sätze | |||||
Die Tribrombenzole (nach der IUPAC Tribrombenzene) bilden in der Chemie eine Stoffgruppe, deren Struktur aus einem Benzolring mit drei Bromatomen (–Br) als Substituenten besteht. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C6H3Br3.
Darstellung
[Bearbeiten | Quelltext bearbeiten]1,2,3-Tribrombenzol
[Bearbeiten | Quelltext bearbeiten]1,2,3-Tribrombenzol wird aus p-Nitroanilin hergestellt, das zunächst mit elementarem Brom und Eisessig an den Positionen 2 und 6 bromiert wird. Dann wird mit einer Sandmeyer-Reaktion die Aminogruppe durch ein Bromatom ersetzt. Das entstandene 3,4,5-Tribromnitrobenzol wird anschließend mit Zinn und Salzsäure zum 3,4,5-Tribromanilin reduziert. Schließlich wird die Aminogruppe nach einer Diazotierung entfernt.[5]
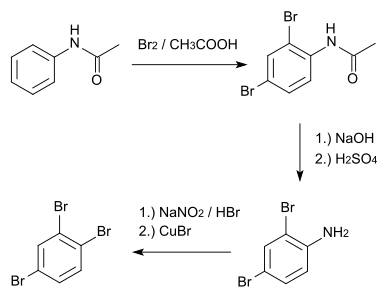
1,2,4-Tribrombenzol
[Bearbeiten | Quelltext bearbeiten]Der Ausgangsstoff für die Darstellung von 1,2,4-Tribrombenzol ist Acetanilid, das zunächst mit gasförmigem Brom, das in eine wässrige Suspension eingeleitet wird, an den Positionen 2 und 4 bromiert wird. Durch Behandeln mit Natronlauge und anschließendem Kochen mit Schwefelsäure entsteht 2,4-Dibromanilin. Durch eine Sandmeyer-Reaktion kann die Aminogruppe anschließend durch ein Bromatom ersetzt werden.[6]
1,3,5-Tribrombenzol
[Bearbeiten | Quelltext bearbeiten]1,3,5-Tribrombenzol wird aus Anilin hergestellt, das mit elementarem Brom in Salzsäure zum 2,4,6-Tribromanilin umgewandelt wird.[7] Diese Verbindung wird anschließend diazotiert und mit Schwefelsäure in Ethanol zum gewünschten Produkt umgesetzt.[7][8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,2,4-Tribrombenzol
[Bearbeiten | Quelltext bearbeiten]1,2,4-Tribrombenzol kristallisiert in Nadeln mit aromatischem Geruch. Es ist in Ethanol und Diethylether löslich, jedoch nur wenig löslich in Benzol.[9] In Wasser ist es praktisch unlöslich (0,0101 g/l).[10] Der Flammpunkt von 1,2,4-Tribrombenzol liegt über 110 °C.[11] Nitrierung von 1,2,4-Tribrombenzol mit Salpetersäure und Schwefelsäure führt zu 1,2,4-Tribrom-3,5-dinitrobenzol.[6]
1,3,5-Tribrombenzol
[Bearbeiten | Quelltext bearbeiten]1,3,5-Tribrombenzol kristallisiert im orthorhombischen Kristallsystem mit der Raumgruppe P212121 (Raumgruppen-Nr. 19) und den Gitterparametern a = 1424,4 pm, b = 1357,7 pm und c = 408,4 pm. In der Elementarzelle befinden sich 4 Formeleinheiten. Es ist isomorph zu 1,3,5-Trichlorbenzol.[12] Es ist wenig löslich in heißem Ethanol. Mit Natriummethanolat reagiert es bei 130 °C zu 3,5-Dibromphenol.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ S. L. Solenova, T. L. Khotsyanova, Yu. T. Struchkov: Steric hindrance and molecular conformation. In: Bulletin of the Academy of Sciences of the USSR Division of Chemical Science. 9, 1960, S. 292–299, doi:10.1007/BF00942906.
- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-488.
- ↑ Datenblatt 1,2,4-Tribromobenzene bei Sigma-Aldrich, abgerufen am 11. Mai 2011 (PDF).
- ↑ Datenblatt 1,3,5-Tribromobenzene bei Sigma-Aldrich, abgerufen am 11. Mai 2011 (PDF).
- ↑ C. L. Jackson, F. B. Gallivan: "On the 3,4,5-Tribromaniline and some derivatives of unsymmetrical tribrombenzol", in: American Chemical Journal, 1898, 20, S. 179–189; Volltext.
- ↑ a b C. L. Jackson, F. B. Gallivan: "Some derivatives of unsymmetrical tribrombenzol", in: American Chemical Journal, 1896, 18, S. 238–252; Volltext.
- ↑ a b G. H. Coleman, W. F. Talbot: sym.-Tribromobenzene In: Organic Syntheses. 13, 1933, S. 96, doi:10.15227/orgsyn.013.0096; Coll. Vol. 2, 1943, S. 592 (PDF).
- ↑ Versuchsvorschrift: 1,3,5-Tribrombenzol (PDF) der Sammlung Integriertes Organisch-chemisches Praktikum der Universität Regensburg, abgerufen am 30. Oktober 2011.
- ↑ a b Heilbron: "Dictionary of organic compounds, Volume Four", 1953, S. 545; Volltext.
- ↑ IUPAC-NIST Solubility Database
- ↑ MSDS bei www.chemcas.com
- ↑ A. Belaaraj, Nguyen-ba-Chanh, Y. Haget, M. A. Cuevas-Diarte: "Crystal data for 1,3,5-trichlorobenzene and 1,3,5-tribromobenzene at 293 K", in: J. Appl. Cryst., 1984, 17, S. 211; doi:10.1107/S002188988401133X.