1,2-Dioxetandion
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | 1,2-Dioxetandion | |||||||||
| Andere Namen |
1,2-Dioxetan-3,4-dion | |||||||||
| Summenformel | C2O4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 88,02 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
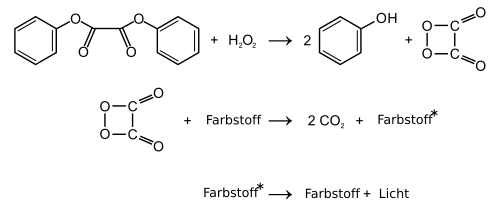
1,2-Dioxetandion wurde als reaktive Zwischenstufe (Intermediat) der Chemilumineszenz-Reaktion von Oxalsäurearylestern mit Wasserstoffperoxid vorgeschlagen (Peroxyoxalat-Chemilumineszenz).[2][3] Die Existenz der heterocyclischen Verbindung scheint jedoch unsicher zu sein.[4] Als chemische Verbindung würde 1,2-Dioxetandion zur Klasse der Dioxetane und den organischen Peroxiden, speziell den Peroxylacetonen zählen. Der Vierring-Heterocyclus kann auch als cyclisches Oxid des Kohlenstoffs bzw. als Dimer von Kohlenstoffdioxid aufgefasst werden.
Es wurde postuliert, dass 1,2-Dioxetandion in einer exergonischen Reaktion in zwei Moleküle Kohlendioxid zerfällt. Die Energie soll auf Farbstoffmoleküle (Fluoreszenzfarbstoffe) übertragen werden, wodurch das Phänomen der Chemolumineszenz auftritt.
Für die Energieübertragung wurden noch weitere Zwischenstufen diskutiert.[5] Der Nachweis von 1,2-Dioxetandion in der Gasphase durch massenspektroskopische Methoden[6][7] wurde bestritten.[4][8] In Lösung konnte die Verbindung jedoch durch 13C-NMR-spektroskopische Untersuchung der Reaktion von 13C-markiertem Oxalylchlorid mit Wasserstoffperoxid identifiziert werden.[9][10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]In Leuchtstäben werden als Ausgangsstoffe zur Erzeugung des postulierten 1,2-Dioxetandions Derivate der Oxalsäure verwendet. Beispiele sind Bis(2,4,6-trichlorphenyl)oxalat (TCPO) oder Bis(2,3-dinitrophenyl)oxalat (DNPO).[S 1] Der heute am häufigsten kommerziell eingesetzte Ausgangsstoff ist jedoch Bis(2,4,5-trichlorophenyl-6-carbopentoxyphenyl)oxalat (CPPO).[S 2] Alle diese Ausgangsstoffe sind Acylierungsmittel („Reaktivester“) und sollen bei Zugabe von Wasserstoffperoxid zu zwei Äquivalenten des (substituierten) Phenols und 1,2-Dioxetandion reagieren.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ M. M. Rauhut, B. G. Roberts, A. M. Semael, J. Am. Chem. Soc., 88, 1966, S. 3604.
- ↑ M. M. Rauhut, Chemiluminescence from Concerted Peroxide Decomposition Reaktions, Accounts of Chemical Research, 2, 1969, S. 80–87.
- ↑ Waldemar Adam, Faris Yany: 1,2-Dioxetanes and α-Peroxylactones. In: Alfred Hassner: Chemistry of Heterocyclic Compounds: Small Ring Heterocycles, Part 3: Oxiranes, Arene Oxides, Oxaziridines, Dioxetanes, Thietanes, Thietes, Thiazetes, and Others. Band 42. John Wiley & Sons 1985, ISBN 978-0-470-18720-3, S. 351–420, insbesondere S. 370.
- ↑ Herbert Brandl, Chemolumineszenz, in: Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer, Photochemie: Konzepte, Methoden, Experimente, Kapitel 6, S. 244–249, Wiley-VCH, Weinheim u. a. O., 1998, ISBN 3-527-29545-3.
- ↑ Herman F. Cordes, Herbert P. Richter, Carl A. Heller: Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. In: J. Am. Chem. Soc. Band 91, Nr. 25, 1969, S. 7209, doi:10.1021/ja01053a065.
- ↑ J. Stauff, W. Jaeschke, G. Schlögl: Chemolumineszenz des „Dioxetandions“. In: Zeitschrift für Naturforschung B. 27, 1972, S. 1434 (online).
- ↑ J. J. DeCorpo, A. Baranowski, M. V. McDowell, F. E. Saalfeld, Formation of carbon dioxide dimer in chemiluminescent reactions, J. Am. Chem. Soc., 94 (8), 1972, S. 2879-2880, doi:10.1021/ja00763a067.
- ↑ Richard Bos, Neil W. Barnett, Gail A. Dyson, Kieran F. Lim, Richard A. Russell, Simon P. Watson, Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 1. Confirmation of 1,2-dioxetanedione as an intermediate using 13C nuclear magnetic resonance spectroscopy, Analytica Chimica Acta 502, 2004, S. 2141–2147, doi:10.1016/j.aca.2003.10.014.
- ↑ Sarah A. Tonkin, Richard Bos, Gail A. Dyson, Kieran F. Lim, Richard A. Russell, Simon P. Watson, Christopher M. Hindson, Neil W. Barnett, Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 2. Further identification of intermediates using 2D EXSY 13C nuclear magnetic resonance spectroscopy, Analytica Chimica Acta, 614, 2008, S. 2173–2181, doi:10.1016/j.aca.2008.03.009.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bis(2,3-dinitrophenyl)oxalat: CAS-Nr.: 16536-30-4, EG-Nr.: 628-468-7, ECHA-InfoCard: 100.156.735, PubChem: 3080704, ChemSpider: 2338445, Wikidata: Q4917155.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bis(2,4,5-trichlorophenyl-6-carbopentoxyphenyl)oxalat: CAS-Nr.: 30431-54-0, EG-Nr.: 250-195-3, ECHA-InfoCard: 100.045.618, PubChem: 93137, ChemSpider: 84082, Wikidata: Q15410297.