1,3-Cyclobutandion
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,3-Cyclobutandion | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H4O2 | ||||||||||||
| Kurzbeschreibung |
fast weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 84,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
leicht löslich in Wasser und Dichlormethan[1] | ||||||||||||
| Brechungsindex |
1,4287 (25 °C, 589 nm)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
1,3-Cyclobutandion ist ein viergliedriges gesättigtes Ringmolekül mit zwei β-ständigen Carbonylgruppen. Die Verbindung ist wie Diketen C4H4O2 eines der stabileren Dimerisierungsprodukte des Ketens C2H2O und Ausgangsstoff für das Cyclobutenderivat Quadratsäure.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1962 veröffentlichten Harry Wasserman und Eckehard Dehmlow erstmals die Synthese von 1,3-Cyclobutandion[1] aus 3-Ethoxy-2-cyclobutenon, das durch 2+2-Cycloaddition von Ethoxyethin[4][5] und Keten erhalten wird.[6][7]

Das Produkt fällt in 30%iger Ausbeute an und kann durch Umkristallisation mit Diethylether gereinigt werden.
Eine neuere Variante dieser Reaktion basiert auf tert.-Butyloxyacetylen – in einer dreistufigen Reaktion aus Ethylvinylether[8] erhältlich – das beim Erhitzen zu 3-tert.-Butoxy-2-cyclobutenon reagiert, aus dem mit Trifluoressigsäure TFA unter Abspaltung von Isobuten in 62 % Gesamtausbeute Cyclobutan-1,3-dion entsteht.[9]
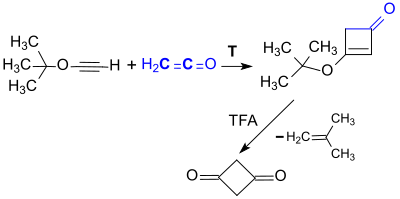
Aus dem (schwarzen) Destillationsrückstand der Diketenproduktion lässt sich Triketen (3-Acetoxy-2-cyclobuten-1-on, das Monoenolacetat des 1,3-Cyclobutandions) isolieren, das mit Ameisensäure unter Abspaltung der Acetylgruppe in 96%iger Ausbeute zu Cyclobutan-1,3-dion reagiert.[10]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,3-Cyclobutandion ist ein fast weißer Feststoff, der in dünnen Blättchen kristallisiert und sich in Wasser und in Methylenchlorid gut löst.[1] Beim Schmelzen zersetzt sich die Substanz heftig zu einer roten Flüssigkeit. Der in der Literatur[2] angegebene Siedepunkt von 500,5 K für Cyclobutan-1,3-dion ist daher fragwürdig. In unpolaren Lösungsmitteln, z. B. Chloroform CHCl3 liegt die Substanz überwiegend in der Ketoform, in polaren Medien, z. B. DMSO, existiert die Enolform in höheren Anteilen, die sich als starke Säure (pKS ≃ 3) und durch sofortige Entfärbung von Bromlösung in CHCl3 oder heftige Reaktion mit Diazomethan in Diethylether manifestiert.[1]

Wegen der allmählichen Zersetzung der Substanz bei Raumtemperatur wird die Überführung des Cyclobutan-1,3-dions in seiner Enolform (3-Hydroxy-2-cyclobuten-1-on) in stabile Dialkylaminsalze, z. B. Dicyclohexylamin, empfohlen, aus denen durch Ansäuern das Diketon zurückerhalten werden kann.[11]

In der Stabilitätsskala der C4H4O2-Isomeren[12] steht 1,3-Cyclobutandion (II) (Ketoform) vor seiner Enolform (IIa) hinter dem stabileren Diketen (I) und vor dem weniger stabilen 2,4-Dimethylen-1,3-dioxetan (III) (CAS-Nr. 68498-71-5) und dem nicht literaturbekannten 2-Methylenoxetan-3-on (IV).[13][14]

Zur Stabilisierung kann 1,3-Cyclobutandion auch zu den entsprechenden Bis-Ketalen umgesetzt werden.[15]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]1,3-Cyclobutandion hat trotz geringer Kosten und einfacher Zugänglichkeit aus Triketen als Neben- und letztlich Abfallprodukt der Diketenproduktion praktisch nur Verwendung als Ausgangsstoff für Quadratsäure gefunden. Dazu wird Chlor an Cyclobutan-1,3-dion addiert zum 2,4,4-Trichlor-3-hydroxy-2-cyclobuten-1-on (90 % Ausbeute) und dieses mit Schwefelsäure zu Quadratsäure umgesetzt (58 %).[10]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f H.H. Wasserman, E.V. Dehmlow: Cyclobutane-1,3-dione. In: J. Amer. Chem. Soc. Band 84, Nr. 19, 1962, S. 3786–3787, doi:10.1021/ja00878a051.
- ↑ a b c Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 42.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E.R.H. Jones, G. Eglinton, M.C. Whiting, B.L. Shaw: Ethoxyacetylene In: Organic Syntheses. 34, 1954, S. 46, doi:10.15227/orgsyn.015.0014; Coll. Vol. 4, 1963, S. 404 (PDF).
- ↑ E.V. Dehmlow, M. Lissel: A convenient route to alkynes via phase transfer catalysis: Applications of phase transfer analysis, part 19. In: Tetrahedron. Band 37, Nr. 9, 1981, S. 1653–1658, doi:10.1016/S0040-4020(01)98925-2.
- ↑ H.H. Wasserman, E. Dehmlow: Cycloaddition of ketenes to ethoxyacetylene: The monoenolether of cyclobutane-1,3-dione. In: Tetrahedron Letters. Nr. 23, 1962, S. 1031–1034, doi:10.1016/S0040-4039(00)70952-X.
- ↑ H.H. Wasserman, J.U. Piper, E.V. Dehmlow: Cyclobutenone derivatives from ethoxyacetylene. In: J. Org. Chem. Band 38, Nr. 8, 1973, S. 1451–1455, doi:10.1021/jo00948a003.
- ↑ M.A. Pericàs, F. Serratosa, E. Valenti: An efficient synthesis of tert-alkoxyethynes. In: Tetrahedron. Band 43, Nr. 10, 1987, S. 2311–2316, doi:10.1016/S0040-4020(01)86815-0.
- ↑ M.A. Pericàs, F. Serratosa, E. Valentini: Expedient synthesis of 1,3-cyclobutanedione via thermal decomposition of t-butoxy ethyne. In: Synthesis. Band 12, 1985, S. 1118–1120, doi:10.1055/s-1985-31444.
- ↑ a b Patent US5130492: Process for the production of squaric acid. Angemeldet am 7. Februar 1991, veröffentlicht am 14. Juli 1992, Anmelder: Lonza Ltd., Erfinder: T. Scholl, B. Jackson.
- ↑ Patent EP0444563B1: 3-Hydroxy-2-cyclobuten-1-on-salze, deren Herstellung und Verwendung. Angemeldet am 25. Februar 1991, veröffentlicht am 23. November 1994, Anmelder: Lonza AG, Erfinder: B. Jackson, T. Scholl.
- ↑ E.T. Seidl, H.F. Schaefer III: Diketene and its cyclic C4H4O2 isomers 1,3-cyclobutanedione and 2,4-dimethylene-1,3-dioxetane. In: J. Amer. Chem. Soc. Band 112, Nr. 4, 1990, S. 1493–1499, doi:10.1021/ja00160a030.
- ↑ G. Morales, R. Martinez, T. Ziegler: Theoretical comparison of ketene dimerization in the gas and liquid phase. In: J. Phys. Chem. A. Band 112, Nr. 4, 2008, S. 3192–3200, doi:10.1021/jp711204v.
- ↑ G. Morales, R. Martinez: Thermochemical properties and contribution groups for ketene dimers and related structures from theoretical calculations. In: J. Phys. Chem. A. Band 113, Nr. 30, 2009, S. 8683–8703, doi:10.1021/jp9030915.
- ↑ Patent EP0562530A1: 1,3-Cyclobutandion, bisketale, Verfahren zu ihrer Herstellung und ihre Verwendung. Angemeldet am 22. März 1993, veröffentlicht am 29. September 1993, Anmelder: Lonza AG, Erfinder: B. Jackson.