1-Vinylimidazol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1-Vinylimidazol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H6N2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 94,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
0,5 hPa (20 °C)[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,5300 (25 °C, 589 nm)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[7] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1-Vinylimidazol ist ein wasserlösliches basisches Monomer, das durch radikalische Polymerisation quaternisierbare Homopolymere und mit einer Vielzahl von Vinyl- und Acryl-Monomeren funktionelle Copolymere bildet. N-Vinylimidazol fungiert als Reaktivverdünner in UV-Lacken, -Tinten und -Klebstoffen, sowie als Monomer für wasserlösliche Polymere, die Anwendung als Ölfeldchemikalien und als Kosmetikhilfsstoffe finden.
Vorkommen und Darstellung
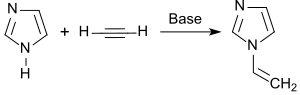
[Bearbeiten | Quelltext bearbeiten]Synthese und Eigenschaften von 1-Vinylimidazol wurden von Walter Reppe 1957 in einem zusammenfassenden Artikel beschrieben.[8] Dabei wird Imidazol zunächst mit Kalilauge zum Kalium-imidazolat umgesetzt und das Wasser destillativ entfernt. Dem basischen Katalysator Kalium-imidazolat wird Zinkoxid und Kaliumhydroxid zugesetzt und das freie Imidazol in 1,4-Dioxan bei 130 °C mit Acetylen im Autoklaven ethinyliert. Die Ausbeute beträgt 62 %.
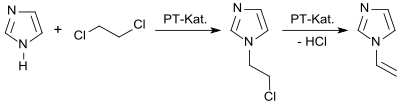
In einem Laborverfahren reagiert Imidazol in einem Zweiphasensystem in Gegenwart eines Phasentransferkatalysators mit 1,2-Dichlorethan zum 1-(2-Chlorethyl)imidazol und dieses unter Abspaltung von Chlorwasserstoff in 92%iger Ausbeute zum 1-Vinylimidazol.[9]
Eine ebenfalls für Labormengen brauchbare Vorschrift gibt die Vinylierung von Imidazol mit Bromethen und Kieselgur-geträgertem Cäsiumfluorid in Acetonitril mit einer Ausbeute von 65 % an.[10]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1-Vinylimidazol ist eine farblose bis braune, lichtempfindliche, hygroskopische und schwach alkalisch reagierende Flüssigkeit mit unangenehmem, an verfaulenden Fisch erinnerndem, Amingeruch. Die Verbindung ist sehr gut löslich in Wasser und Alkoholen. Die radikalische Polymerisation von 1-Vinylimidazol verläuft bei pH 9 nur sehr langsam, bei pH 1 aber so schnell wie die von quaternisiertem 1-Vinylimidazol.[11]
1-Vinylimidazol hat einen Flammpunkt von 84 °C, eine Zersetzungstemperatur von 220 °C und hat eine Zündtemperatur von 415 °C.[3]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Wegen seiner hohen Reaktivität für die radikalische (UV)-Polymerisation wird 1-Vinylimidazol als so genannter Reaktivverdünner in UV-Lacken, -Tinten und -Klebstoffen für Beschichtungen und Lacke sowie zur Funktionalisierung von Polymeroberflächen durch UV-induzierte Pfropfung zur Verbesserung der Benetzbarkeit und des Haftvermögens eingesetzt.
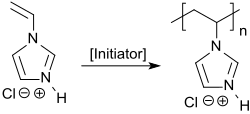
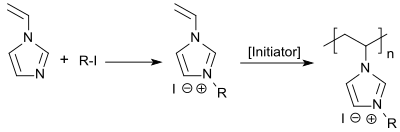
1-Vinylimidazol kann mit n-Alkyliodiden zu 3-n-Alkyl-1-vinylimidazoliumiodiden und mit Dimethylsulfat zum 3-Methyl-1-vinylimidazolium-methosulfat quaternisiert werden.[12] Die erhaltenen quartären Ammoniumverbindungen können in wässriger Lösung mit dem wasserlöslichen Azoinitiator 4,4'-Azobisvaleriansäure radikalisch polymerisiert werden.
Copolymere von quartären N-Vinylimidazoliumsalzen und polaren Monomeren, insbesondere N-Vinylpyrrolidon, stellen kationische Polyelektrolyte dar und eignen sich u. a. als Flockungsmittel für die Wasseraufbereitung, als Flotationshilfsmittel für die Kohle- und Erzaufbereitung, als Additive für Bohrspülungen und -zementierungen in der Erdölförderung, als Emulsionsspalter für die Entwässerung von Rohölemulsionen in Raffinerien, sowie als Korrosionsinhibitoren für Eisenlegierungen.[13]
Copolymere von quartären N-Vinylimidazoliumsalzen und polymerisierbaren ungesättigten Carbonsäuren, wie z. B. Methacrylsäure oder Sulfonsäuren, wie z. B. 2-Acrylamido-2-methylpropansulfonsäure reduzieren die elektrostatische Aufladung, z. B. von Haaren und werden deshalb in Shampoos zur Verbesserung der Nasskämmbarkeit eingesetzt.[14]
1-Vinylimidazol polymerisiert in wässriger oder alkoholischer Lösung radikalisch zu Homopolymeren mit mittleren molare Massen von 2,000 bis 50,000,[4] die jedoch oft noch relativ hohe Restmonomergehalte (> 600 ppm) enthalten.[15] Durch Zusatz schwefelhaltiger Regler, wie z. B. Mercaptoethanol, kann der unerwünschte Restgehalt des übelriechenden N-Vinylimidazols auf weniger als 50 ppm reduziert werden, wobei allerdings auch die Molmasse des erhaltenen Polymers abnimmt.[4]
Hydrogele aus Poly-1-vinylimidazol binden sehr effizient eine große Zahl von Schwermetallionen (außer Pb2+), die selektiv und quantitativ aus dem Hydrogel wieder eluiert werden können.[16]
Das 1-Vinylimidazol selbst kann mit einer Vielzahl von Vinyl- und Acrylmonomeren radikalisch copolymerisiert werden. Wasserlösliche Copolymere mit Vinylpyrrolidon finden Einsatz als Farbübertragungsinhibitoren in Waschmittelzubereitungen,[17]
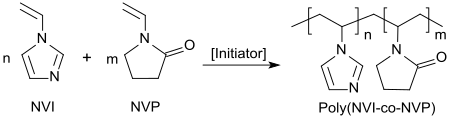
mit Vinylacetat als Beschichtung lithografischer Druckplatten,[18] mit Acrylsäureestern bzw. Methacrylsäureestern oder 2-Hydroxyethylmethacrylat als Haftvermittler in Lacken[19] oder mit Acrylnitril als Precursor für Carbonfaser.[20]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 1-Vinylimidazol bei TCI Europe, abgerufen am 5. April 2017.
- ↑ a b Datenblatt 1-Vinylimidazol bei Sigma-Aldrich, abgerufen am 29. Dezember 2019 (PDF).
- ↑ a b c d e f g Eintrag zu 1-Vinylimidazol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Patent EP0698046B1: Homo- und Copolymerisate von 1-Vinylimidazol, Verfahren zu ihrer Herstellung und ihre Verwendung. Angemeldet am 2. Mai 1994, veröffentlicht am 5. März 1997, Anmelder: BASF AG, Erfinder: J. Detering, W. Denzinger.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2014, ISBN 978-0-323-28659-6, S. 67.
- ↑ Eintrag zu 1-vinylimidazole im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 26. Juni 2020.
- ↑ W. Reppe: Vinylierung. In: Justus Liebigs Ann. Chem. Band 601, Nr. 1, 1957, S. 81–138, doi:10.1002/jlac.19566010106.
- ↑ D. Bogdal, K. Jaskat: Synthesis of vinyl monomers with active azaaromatic groups. Phase-transfer catalytic approach. In: Synth. Commun. Band 30, Nr. 18, 2000, S. 3341–3352, doi:10.1080/00397910008086974.
- ↑ S. Hayat et al.: N-Alkylation of anilines, carboxamides and several nitrogen heterocycles using CsF-Celite/alkyl halides/CH3CN combination. In: Tetrahedron. Band 57, Nr. 50, 2001, S. 9951–9957, doi:10.1016/S0040-4020(01)00989-9.
- ↑ S. Santanakrishnan, R.A. Hutchinson: Free-radical polymerization of N-vinylimidazole and quaternized vinylimidazole in aqueous solution. In: Macromol. Chem. Phys. Band 214, Nr. 10, 2013, S. 1140–1146, doi:10.1002/macp.201300044.
- ↑ J.C. Salamone, S.C. Israel, P. Taylor, B. Snider: Synthesis and homopolymerization studies of vinylimidazolium salts. In: Polymer. Band 14, Nr. 12, 1973, S. 639–644, doi:10.1016/0032-3861(73)90039-6.
- ↑ Patent EP0544158A1: Verwendung von Homo- und Copolymerisaten auf Basis von quaternisierten 1-Vinylimidazolen als organische Polyelektrolyte. Angemeldet am 26. November 1991, veröffentlicht am 2. Juni 1993, Anmelder: BASF AG, Erfinder: H. Meyer, A. Sanner, R.-D. Reinhardt, F. Frosch, H.-J. Raubenheimer.
- ↑ Patent US6355231B1: Use of cationic copolymers of unsaturated acids and N-vinylimidazolium salts in cosmetic hair formulations. Angemeldet am 8. Oktober 1998, veröffentlicht am 12. März 2002, Anmelder: BASF AG, Erfinder: R. Dieing, P. Hössel, A. Sanner.
- ↑ Patent DE2814287: Waschmittel mit einem Gehalt an verfärbungsinhibierenden Zusätzen. Angemeldet am 3. April 1978, veröffentlicht am 11. Oktober 1979, Anmelder: Henkel KGaA, Erfinder: H. Waldhoff, E. Schmadel, K. Engelskirchen, J. Galinke.
- ↑ B.L. Rivas, H.A. Maturana, M.J. Molina, M.R. Gómez-Aaantón, I.F. Piérola: Metal ion binding properties of poly(N-vinylimidazole) hydrogels. In: J. Appl. Polym. Sci. Band 67, Nr. 6, 1998, S. 1109–1118, doi:10.1002/(SICI)1097-4628(19980207)67:6<1109::AID-APP19>3.0.CO;2-V.
- ↑ Patent US6172027B1: Use of watersoluble copolymers comprising N-vinylimidazole units as color transfer inhibitors in detergents. Angemeldet am 4. Dezember 1997, veröffentlicht am 9. Januar 2001, Anmelder: BASF AG, Erfinder: D. Boeckh, S. Stein, A. Funhoff, J.A. Lux, H.-U. Jäger.
- ↑ Patent US6649323B2: Overcoat for light-sensitive materials comprising (1-vinylimidazole) polymer or copolymer. Angemeldet am 21. Januar 2000, veröffentlicht am 18. November 2003, Anmelder: Kodak Polychrome Graphics LLC, Erfinder: S.P. Peppas, H. Baumann, U. Dwars, C.M. Savariar-Hauck, H.-J. Timpe.
- ↑ Patent US8512465B2: Use of copolymers as adhesion promotors in lacqueurs. Angemeldet am 15. November 2007, veröffentlicht am 20. August 2013, Anmelder: BYK-Chemie GmbH, Erfinder: K. Haubennestel, S. Mossmer, T. Launag, A. Frank.
- ↑ W. Deng: Poly(acrylonitrile-co-1-vinylimidazole): A new melt processable carbon fiber precursor. Hrsg.: Clemson University, Tiger Prints. Clemson 2010 (Online).


