10-Undecin-1-ol
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | 10-Undecin-1-ol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C11H20O | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 168,28 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte | ||||||||||
| Siedepunkt | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Alkoholen wie Methanol[4] und Ethanol, in Chlorkohlenwasserstoffen wie Dichlormethan[5] und Chloroform[6], sowie in Tetrahydrofuran | |||||||||
| Brechungsindex | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
10-Undecin-1-ol ist ein natürlich vorkommendes, lineares Alkinol mit endständiger Ethinylgruppe. Es ist synthetisch aus 10-Undecen-1-ol bzw. 10-Undecinsäure oder Methylundecinoat einfach zugänglich.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Reduktion von 10-Undecinsäure mit Lithiumaluminiumhydrid in Diethylether ergibt 10-Undecinol in einer Ausbeute von 89 % d.Th.[3]
10-Undecinol kann durch Isomerisierung von 2-Undecin-1-ol (aus der Umsetzung von Propargylalkohol mit n-Octyllithium)[7] in 93%iger Ausbeute erhalten werden.
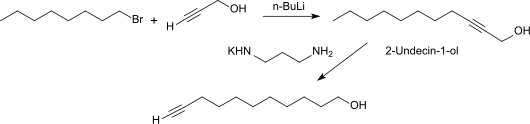
Die Verschiebung der innenständigen Dreifachbindung an das Kettenende gelingt glatt mit dem Kaliumamid des 1,3-Diaminopropans.[8]
Analog zur Darstellung der 10-Undecinsäure aus Undecylensäure kann 10-Undecin-1-ol aus 10-Undecen-1-ol durch Bromierung der Doppelbindung und anschließende zweifache Dehydrobromierung mit Natriumamid in flüssigem Ammoniak in 60%iger Ausbeute gewonnen werden.[9]
Ein weiterer Syntheseweg geht aus vom Methylester der 10-Undecinsäure, der mit Tetraisopropylorthotitanat und Polymethylhydrosiloxan (PMHS) in 63%iger Ausbeute zum 10-Undecinol reduziert wird.[10]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]10-Undecin-1-ol ist reinem Zustand eine klare, farblose Flüssigkeit, die bei Temperaturen unter 5 °C zu einer wachsartigen Masse erstarrt. Wie Undecylensäure besitzt auch 10-Undecinol fungizide Wirkung, die allerdings durch seine noch geringere Wasserlöslichkeit eingeschränkt ist. Einschlussverbindungen mit methyliertem β-Cyclodextrin erhöhen die Wasserlöslichkeit und damit die Bioverfügbarkeit von derart solubilisiertem 10-Undecinol, die zu einer erheblich gesteigerten Wirksamkeit gegen phytopathogene Pilze, wie Rosellina necatrix führen.[11]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]10-Undecinol ist ein wichtiger Baustein in einer Syntheseroute zum Insektenpheromon Bombykol, das als Sexuallockstoff beim Seidenspinner wirkt.[12] Eine konvergente stereospezifische Synthese basiert auf den Ausgangsmaterialien 10-Undecinol und 1-Pentin.[13]
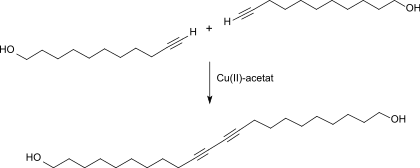
In Analogie zur Herstellung der 10,12-Docosadiin-1,22-disäure aus 10-Undecinsäure durch oxidative Glaser-Kupplung kann 10-Undecin-1-ol in der Variante der Eglinton-Reaktion mit Kupfer(II)-acetat in Pyridin und katalytischen Mengen Kupfer(I)-chlorid in 68%iger Ausbeute zum entsprechenden α,ω-Diol 10,12-Docosadiin-1,22-diol verknüpft werden.[9]
Die einfache Thiol-In-Addition von Mercaptoethanol an die Ethinylgruppe des 10-Undecinols führt zu einem Vinylthioetherderivat, das als Diolkomponente mit MDI (Methylendiphenylisocyanate) zu linearen Polyurethanen reagieren.[14]

Die terminale Ethinylgruppe macht 10-Undecinol zu einem geeigneten Molekül für die Click-Chemie, z. B. für Thiol-In-Kupplungsreaktionen.[15] So reagiert 10-Undecinol (zusammen mit 10-Undecinsäure und 10-Undecinsäuremethylester) in einer photoinitiierten Thiol-In-Reaktion mit 3,6-Dioxa-1,8-dithiol in Gegenwart des Photoinitiators DMPA (2,2-Dimethoxy-2-phenylacetophenon) zu kammartigen Oligothioethern, die als funktionelle Polyole für Polyurethansynthesen Verwendung finden können.[16]

Eine weitere Click-Reaktion, die Kupfer(I)-iodid-katalysierte Azid-Alkin-Cycloaddition (CuAAC, engl. copper(I)-catalyzed azide-alkyne cycloaddition), führt bei der Umsetzung TBDMS (tert-Butyldimethylsilyl)-geschützter Glutarsäurehalbester von 10-Undecinol mit dem Bis-Azid 1,5-Diazido-3-oxapentan [Bis(2-azidoethyl)ether] in 86%iger Ausbeute zu substituierten 1,2,3-Triazolen.[17]

Das entstehende polymerisierbare Bolaamphiphil kann als Modellverbindung für membrandurchspannende Lipide dienen, die den Membranen der biologischen Domäne der Archaeen extreme Stabilität gegen hohen thermischen (bis 121 °C), osmotischen (ca. 30 % NaCl-Lösung) und hydrolytischen (pH 0) Stress verleihen.[18] Die Länge der hydrophoben Kette zwischen den beiden hydrophilen Kopfgruppen des Bistriazol-Bolaamphiphils sollte ausreichen, die ca. 35 Ångström dicke Lipiddoppelschicht von Biomembranen zu durchspannen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt 10-Undecyn-1-ol bei Alfa Aesar, abgerufen am 29. Oktober 2014 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt 10-Undecyn-1-ol, ≥95.0% (GC) bei Sigma-Aldrich, abgerufen am 26. Dezember 2014 (PDF).
- ↑ a b c L.D. Bergel'son, Y.G. Molotkovskii, M.M. Shemyakin: Unsaturated acids and macrocyclic lactones: I. Synthesis of diacetylenic and dienic macrocyclic lactones. In: Zh. Obshch. Khim. Band 32, 1962, S. 58–64 (CA:57,14930 (1962)).
- ↑ S. Inayama, T. Tatewaki, S. Okada: Solid-state polymerization of conjugated hexayne derivatives with different end groups. In: Polymer J. Band 42, 2010, S. 201–207, doi:10.1038/pj.2009.326.
- ↑ H. Woo, Y. You, T. Kim, G.-J. Jhon, W. Nam: Fluorescence ratiometric zinc sensors based on controlled energy transfer. In: J. Mater. Chem. Band 22, 2012, S. 17100, doi:10.1039/c2jm33366j.
- ↑ G.W. Kabalka, M. Varma, R.S. Varma, P.C. Srivastava, F.F. Knapp Jr.: Tosylation of alcohols. In: J. Org. Chem. Band 51, Nr. 12, 1986, S. 2386–2388, doi:10.1021/jo00362a044.
- ↑ H. Winarno: Rapid isomerization of alkynol by potassium aminopropylamide reagent. In: Indo. J. Chem. Band 7, Nr. 3, 2007, S. 320–323 (Online).
- ↑ L. Brandsma: Preparative Acetylenic Chemistry. In: Studies in Organic Chemistry 34. Elsevier, 1988, ISBN 0-444-42960-3, S. 245–246.
- ↑ a b H. Bader, H. Ringsdorf: Liposomes from α,ω-dipolar amphiphiles with a polymerizable diyne moiety in the hydrophobic chain. In: J. Polym. Sci., Polym. Chem. Ed. Band 20, Nr. 6, 1982, S. 1623–1628, doi:10.1002/pol.1982.170200622.
- ↑ M. T. Reding, S. L. Buchwald: An inexpensive air-stable titanium-based system for the conversion of esters to primary alcohols. In: J. Org. Chem. Band 60, Nr. 24, 1995, S. 7884–7890, doi:10.1021/jo00129a031.
- ↑ T. L. Neoh, T. Tanimoto, S. Ikefuji, H. Yoshi, T. Furuta: Improvement of antifungal activity of 10-undecyn-1-ol by inclusion complexation with cyclodextrin derivatives. In: J. Agric. Food Chem. Band 56, Nr. 10, 2008, S. 3699–3705, doi:10.1021/jf.0731898.
- ↑ T. Sakurai, T. Nakagawa, H. Mitsuno, H. Mori, Y. Endo, S. Tanoue, Y. Yasukochi, K. Touhara, T. Nishioka: Identification and functional characterization of a sex pheromone receptor in the silkmoth Bombyx mori. In: Proc. Natl. Acad. Sci. Band 101, Nr. 47, 2004, S. 16653–16658, doi:10.1073/pnas.0407596101.
- ↑ N. Miyaura, H. Suginome, A. Suzuki: New stereospecific syntheses of pheromone bombykol and its three geometrical isomers. In: Tetrahedron. Band 39, Nr. 20, 1983, S. 3271–3277, doi:10.1016/S0040-4020(01)91575-3.
- ↑ R.J. González-Paz, G. Lligadas, J.C. Ronda, M. Galià, V. Cádiz: Thiol-yne reaction of alkyne-derivatized fatty acids: Thiol-reactive linear polyurethane. In: J. Renew. Mater. Band 1, 2013, S. 187, doi:10.7569/JRM.2013.634114.
- ↑ R. Hoogenboom: Thiol-yne chemistry: A powerful tool for creating highly functional materials. In: Angew. Chem. Int. Ed. Band 49, Nr. 20, 2010, S. 3415–3417, doi:10.1002/anie.201000401.
- ↑ C. Lluch, G. Lligadas, J.C. Ronda, M. Galià, V. Cádiz: Thiol-yne approach to biobased polyols: Polyurethane synthesis and surface modification. In: abiosus e.V., 6th Workshop on fats and oils as renewable feedstock for the chemical industry. 2013, S. 67 (online [PDF]).
- ↑ G.M. Mitchell: Design and synthesis of a macrocyclic phospholipid. 8. September 2014 (online).
- ↑ Archaeal Lipids. In: SBKB, PSI-Nature Structural Biology Knowledgebase. 2017, doi:10.3942/psi_sgkb/fm_2012_12.