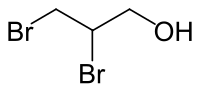
2,3-Dibrom-1-propanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,3-Dibrom-1-propanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6Br2O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 217,89 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
2,116 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,559[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2,3-Dibrom-1-propanol ist eine chemische Verbindung aus der Gruppe der Alkohole.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]2,3-Dibrom-1-propanol kann durch Bromierung von Allylalkohol mit Brom in Gegenwart von wässrigem Lithiumbromid gewonnen werden.[5]
Die beiden Enantiomere der Verbindung erhält man durch Diazotierung der diastereomeren D-Tartrat-Salze von 2,3-Dibrompropylamin.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2,3-Dibrom-1-propanol ist eine brennbare, schwer entzündbare, farblose in Wasser lösliche Flüssigkeit.[1]
Die Verbindung ist ein Metabolit des Flammschutzmittels Tris(2,3-dibrompropyl)phosphat, das mutagene und karzinogene Eigenschaften besitzt. DBP ist strukturverwandt mit 1,2-Dibrom-3-chlorpropan, 1,2-Dichlorpropan und 1,3-Dichlorpropen. Ähnlich wie viele halogenierte aliphatische Alkohole wird DBP im Stoffwechsel oxidiert und dehalogeniert. Das intermediäre Epoxid wird nach Konjugation an Glutathion weiter zur Mercaptursäure metabolisiert. Durch Hydrolyse des Epoxids und sukzessive Oxidation ist auch die Bildung von Bromessigsäure und von Oxalsäure möglich. Das Glutathionkonjugat kann ebenfalls zu einem hoch reaktiven Episulfoniumion verstoffwechselt werden, wodurch eine Adduktbildung am N-7 des Guanins ermöglicht wird.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]2,3-Dibrom-1-propanol wurde als Zwischenprodukt bei der Herstellung von Flammschutzmitteln, Insektiziden und Pharmazeutika verwendet. Insbesondere in den 1970er Jahren wurde es hauptsächlich zur Herstellung des Flammschutzmittels Tris(2,3-dibrompropyl)phosphat verwendet, das in Textilien eingesetzt wurde. Da die technische Produktion dieses Flammschutzmittels eingestellt wurde, ist 2,3-Dibrom-1-propanol heute nur noch in Labormengen verfügbar.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j Eintrag zu 2,3-Dibrom-1-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Juli 2021. (JavaScript erforderlich)
- ↑ a b Datenblatt 2,3-Dibrom-1-propanol, 98% bei Sigma-Aldrich, abgerufen am 22. Juli 2021 (PDF).
- ↑ Eintrag zu 2,3-dibromopropan-1-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Juli 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 20. September 2021.
- ↑ a b IARC: Monographie, abgerufen am 22. Juli 2021.
- ↑ Alain C. Huitric, W. Perry Gordon, Sidney D. Nelson: Preparation of (+)- and (−)-2,3-dibromo-1-propanol. In: Journal of Chemical & Engineering Data. Band 27, Nr. 4, 1982, S. 474–475, doi:10.1021/je00030a033.
- ↑ Technischer Arbeitsschutz (inkl. Technische Regeln) – 2,3-Dibrompropan-1-ol (2,3-Dibrom-1-propanol), Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, abgerufen am 22. Juli 2021.

