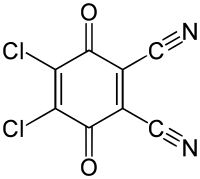
2,3-Dichlor-5,6-dicyano-1,4-benzochinon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,3-Dichlor-5,6-dicyano-1,4-benzochinon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8Cl2N2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
gelber bis oranger geruchloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 227,00 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
2,3-Dichlor-5,6-dicyano-1,4-benzochinon (oder DDQ von englisch 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone) ist eine organische Verbindung und findet als oxidatives Reagenz in der Organischen Chemie Anwendung. DDQ wird zur oxidativen Dehydrogenierung von Alkoholen[2], Phenolen[3] und steroiden Ketonen[4] angewandt. Auch in der Schutzgruppentechnik wird DDQ in der Spaltung von p-Methoxy- (PMB) und 3,4-Dimethoxybenzylethern benutzt.[5] DDQ wird in Wasser zersetzt, ist jedoch stabil in Gegenwart wässriger Mineralsäuren.
Synthese
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1906 wurde von Johannes Thiele und Fritz Günther eine Reaktionssequenz aus Cyanierung und Chlorierung von 1,4-Benzochinon publiziert.[6] Über eine einstufige Reaktion zur Synthese von DDQ wurde 1965 von Derek Walker und Thomas D. Waugh ausgehend von 2,3-Dicyanohydrochinon berichtet.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]DDQ wird von Wasser unter Abspaltung der sehr giftigen Blausäure (HCN) hydrolysiert.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]DDQ ist ein Reagenz, welches als Oxidationsmittel[8] und als Elektronenakzeptor Anwendung findet.[9]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Dehydrierung
[Bearbeiten | Quelltext bearbeiten]DDQ kann zur Dehydrierung von α,β-ungesättigten Carbonylverbindungen, wie am Beispiel eines Steroids gezeigt, verwendet werden.[10]

Aromatisierung
[Bearbeiten | Quelltext bearbeiten]In Anwesenheit von Säuren sind durch Dehydrierung aromatische Steroide zugänglich.[11]

Oxidative Kupplungsreaktionen
[Bearbeiten | Quelltext bearbeiten]DDQ kann auch für oxidative Kupplungen verwendet werden.[12]


Oxidation von Alkoholen
[Bearbeiten | Quelltext bearbeiten]DDQ kann zur Oxidation von Alkoholen verwendet werden. So z. B. in der Oxidation von 1,2-Diolen. Dabei wird die benzylische (R1=C6H5) oder allylische Position selektiv oxidiert.[13]

Schutzgruppenchemie
[Bearbeiten | Quelltext bearbeiten]Schutzgruppen wie PMB (4-Methoxybenzyl) oder DMPM (3,4-Dimethoxybenzyl) können durch stöchiometrische Mengen DDQ in Dichlormethan mit Wasser bei Raumtemperatur entfernt werden.[14][15] Auch Benzylschutzgruppen können unter wässrigen Bedingungen abgespalten werden.[16][17][18] Durch gezielte Lichteinstrahlung können diese auch in trockenem Acetonitril abgespalten werden.[19]

Wird zusätzlich zum DDQ ein Photokatalysator verwendet, so kann das DDQ katalytisch verwendet werden. Auf diesem Weg lassen sich auch Benzylschutzgruppen abspalten.[20]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- „Like Neurons in the Brain“: A Molecular Computer that Evolves ( vom 12. Dezember 2010 im Internet Archive)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b E. A. Braude, R. P. Linstead und K. R. H. Wooldridge: Hydrogen Transfer. 9. The selective dehydrogenation of unsaturated alcohols by high-potential quinones. In: Journal of the American Chemical Society. August 1956, S. 3070–3074, doi:10.1039/JR9560003070.
- ↑ H. D. Becker: Quinone Dehydrogenation .I. Oxidation Of Monohydric Phenols. In: Journal of Organic Chemistry. Band 30, Nr. 4, 1965, S. 982–989, doi:10.1021/jo01015a006.
- ↑ A. B. Turner, H. J. Ringold: Applications of high-potential quinones. Part I. The mechanism of dehydrogenation of steroidal ketones by 2,3-dichloro-5,6-dicyanobenzoquinone. In: Journal of the Chemical Society. 1967, S. 1720–1730, doi:10.1039/J39670001720.
- ↑ Yuji Oikawa, Tadao Yoshioka, Osamu Yonemitsu: Specific removal of o-methoxybenzyl protection by DDQ oxidation. In: Tetrahedron Lett., 23, 1982, S. 885–888; doi:10.1016/S0040-4039(00)86974-9.
- ↑ Johannes Thiele, Fritz Günther: Ueber Abkömmlinge des Dicyanhydrochinons. In: Justus Liebigs Annalen der Chemie. Volume 349, Issue 1, 1906, S. 45–66; doi:10.1002/jlac.19063490103.
- ↑ Derek R. Buckle, Steven J. Collier, Mark D. McLaws: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2005, ISBN 978-0-471-93623-7, 2,3-Dichloro-5,6-dicyano-1,4-benzo-quinone, doi:10.1002/047084289x.rd114.pub2.
- ↑ Meshari A. Alsharif, Qandeel Alam Raja, Nida Abdul Majeed, Rabab S. Jassas, Abdulrahman A. Alsimaree, Amina Sadiq, Nafeesa Naeem, Ehsan Ullah Mughal, Reem I. Alsantali, Ziad Moussa, Saleh A. Ahmed: DDQ as a versatile and easily recyclable oxidant: a systematic review. In: RSC Advances. Band 11, Nr. 47, 2021, S. 29826–29858, doi:10.1039/D1RA04575J, PMID 35479576.
- ↑ Palani Natarajan, Burkhard König: Excited‐State 2,3‐Dichloro‐5,6‐dicyano‐1,4‐benzoquinone (DDQ*) Initiated Organic Synthetic Transformations under Visible‐Light Irradiation. In: European Journal of Organic Chemistry. Band 2021, Nr. 15, 2021, S. 2145–2161, doi:10.1002/ejoc.202100011.
- ↑ Anne M. Sauer, William E. Crowe, Gregg Henderson, Roger A. Laine: Conformational control of selectivity in the dienone–phenol rearrangement. In: Tetrahedron Letters. Band 48, Nr. 37, 2007, S. 6590–6593, doi:10.1016/j.tetlet.2007.07.001.
- ↑ W. Brown, A. B. Turner: Application of High-potential Quinones. 7. Synthesis of steroidal phenanthrenes by double methyl migration. In: J. Chem. Soc. C. Nr. 14, 1971, S. 2566–2572, doi:10.1039/J39710002566.
- ↑ YH.Zhang, CJ. Li, and Wooldridge, K. R. H.: DDQ-Mediated Direct Cross-Dehydrogenative-Coupling (CDC) between Benzyl Ethers and Simple Ketones. In: Journal of the American Chemical Society. Band 128, Nr. 13, 2006, S. 4242–4243, doi:10.1021/ja060050p.
- ↑ Kun Peng, Fuxin Chen, Xuegong She, Chunhui Yang, Yuxin Cui, Xinfu Pan: Selective oxidation of benzylic or allylic hydroxyl group of sec-1,2-diols. In: Tetrahedron Letters. Band 46, Nr. 7, 2005, S. 1217–1220, doi:10.1016/j.tetlet.2004.12.073.
- ↑ Yuji Oikawa, Tadao Yoshioka, Osamu Yonemitsu: Specific removal of o-methoxybenzyl protection by DDQ oxidation. In: Tetrahedron Letters. Band 23, Nr. 8, 1982, S. 885–888, doi:10.1016/S0040-4039(00)86974-9.
- ↑ Kiyoshi Horita, Tadao Yoshioka, Tatsuyoshi Tanaka, Yuji Oikawa, Osamu Yonemitsu: On the selectivity of deprotection of benzyl, mpm (4-methoxybenzyl) and dmpm (3,4-dimethoxybenzyl) protecting groups for hydroxy functions. In: Tetrahedron. Band 42, Nr. 11, 1986, S. 3021–3028, doi:10.1016/S0040-4020(01)90593-9.
- ↑ Barry M. Trost, Julien P. N. Papillon: Alkene−Alkyne Coupling as a Linchpin: An Efficient and Convergent Synthesis of Amphidinolide P. In: Journal of the American Chemical Society. Band 126, Nr. 42, 2004, S. 13618–13619, doi:10.1021/ja045449x.
- ↑ Norihiro Ikemoto, Stuart L. Schreiber: Total synthesis of (-)-hikizimycin employing the strategy of two-directional chain synthesis. In: Journal of the American Chemical Society. Band 114, Nr. 7, 1992, S. 2524–2536, doi:10.1021/ja00033a029.
- ↑ Seungyoup Baek, Hyunil Jo, Hansoo Kim, Hyoungsu Kim, Sanghee Kim, Deukjoon Kim: Highly Stereoselective and Efficient Total Synthesis of (+)-Laurencin. In: Organic Letters. Band 7, Nr. 1, 2005, S. 75–77, doi:10.1021/ol047877d.
- ↑ Mohammad Abdur Rahim, Shuichi Matsumura, Kazunobu Toshima: Deprotection of benzyl ethers using 2,3-dichloro-5,6-dicyano-p-benzoquinone (DDQ) under photoirradiation. In: Tetrahedron Letters. Band 46, Nr. 43, 2005, S. 7307–7309, doi:10.1016/j.tetlet.2005.08.132.
- ↑ Samuzal Bhuyan, Susanta Mandal, Saibal Jana, Karan Chhetri, Biswajit Gopal Roy: Efficient Greener Visible‐Light‐Catalyzed Debenzylation of Benzyl Ethers and Esters: A Gateway to Wider Exploitation of Stable Benzyl Protecting Groups. In: Asian Journal of Organic Chemistry. Band 11, Nr. 7, 2022, doi:10.1002/ajoc.202200185.
