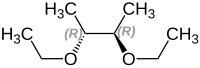2,3-Diethoxybutan
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Name | 2,3-Diethoxybutan | |||||||||
| Summenformel | C8H18O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 146,23 g·mol−1 | |||||||||
| Brechungsindex |
1,3960 (Diastereomerengemisch)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
2,3-Diethoxybutan, ein Derivat von Butylenglykol, kann als Chelatligand für Magnesium-Komplexe dienen.[3]
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]Es existieren drei Stereoisomere des 2,3-Diethoxybutans. Eines davon ist die meso-Form und zwei sind zueinander spiegelbildlich, also Enantiomere:
-
(2R,3R)-2,3-Diethoxybutan
-
(2S,3S)-2,3-Diethoxybutan
-
meso-2,3-Diethoxybutan
Darstellung
[Bearbeiten | Quelltext bearbeiten]2,3-Diethoxybutan ist ein formales Kondensationsprodukt von zwei Molekülen des Diethylethers. Es kann radikalisch aus diesem synthetisiert werden, etwa mit dem Radikalbildner Ditertbutylperoxid. Dieser Syntheseweg wurde 1964 von Klaus Schwetlick et al. gezeigt.[1] Nebenprodukte sind hauptsächlich Aceton und Ethan. Die möglichen, ablaufenden Reaktionen hierbei sind:

Der obige Syntheseweg wurde von Schwetlick et al. als Dehydrodimerisierung bezeichnet und kann auch bei anderen Edukten angewendet werden, etwa um Acetonylaceton aus Aceton zu erzeugen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b K. Schwetlick, J. Jentzsch, R. Karl, D. Wolter: Dehydrodimerisierungen mit Di-tert.-butylperoxid. In: Journal für praktische Chemie. Band 25, Nr. 1–2, 1964, S. 95–100, doi:10.1002/prac.19640250112.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. Langer, S. Krieck, R. Fischer, H. Görls, D. Walther, M. Westerhausen: 1,4-Dioxane Adducts of Grignard Reagents: Synthesis, Ether Fragmentation Reactions, and Structural Diversity of Grignard Reagent/1,4-Dioxane Complexes. In: Organometallics. Band 28, Nr. 19, 2009, S. 5814–5820, doi:10.1021/om9000567.