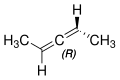
2,3-Pentadien
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
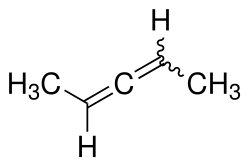
| |||||||||||||
| Strukturformel ohne Angabe zur Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 2,3-Pentadien | ||||||||||||
| Andere Namen |
1,3-Dimethylallen | ||||||||||||
| Summenformel | C5H8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 68,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
0,695 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
48,2 °C[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,4284[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
2,3-Pentadien ist eine chirale chemische Verbindung aus der Gruppe der ungesättigten aliphatischen Kohlenwasserstoffe.
Isomere
[Bearbeiten | Quelltext bearbeiten]2,3-Pentadien ist eine axial chirale Verbindung. Es gibt zwei Stereoisomere, die als (R)- bzw. (S)-2,3-Pentadien bezeichnet werden.
-
(R)-2,3-Pentadien
-
(S)-2,3-Pentadien
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Verbindung kann durch Reduktion von 2-Chlor-3-pentin gewonnen werden.[3] Es ist auch die Synthese ausgehend von trans-2-Buten bekannt.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2,3-Pentadien ist eine Flüssigkeit, die nahezu unlöslich in Wasser ist.[1] Bei einer Temperatur von 140 °C in einem angeschlossenen Gefäß dimerisiert die Verbindung zu zum cyclischen 3,4-Dimethyl-1,2-diethyliden-cyclobutanen, wobei bevorzugt die trans-Form der Verbindungen entstehen.[5] Bei Addition von Brom entsteht in Tetrachlorkohlenstoff eine Mischung aus cis- und trans-3,4-Dibrompenten.[6] Mit Iod bildet sich 2,3-Diiod-3-penten.[7] In Methanol bildet sich mit Brom ein Gemisch aus cis- und trans-Brom-4-methoxy-2-penten.[6] Mit t-Butylhypochlorit reagiert 2,3-Pentadien zu einer Vielzahl von Reaktionsprodukten.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 978-1-4398-8049-4, S. 3–436 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Freddie Kimble: PREPARATION OF PENTADIENE-2,3, 1952, abgerufen am 24. April 2022.
- ↑ Stanley R. Sandler, Wolf Karo: Sourcebook of Advanced Organic Laboratory Preparations. Academic Press, 2012, ISBN 978-0-08-092553-0, S. 195 (books.google.de).
- ↑ Joseph J. Gajewski, Walter A. Black: Thermal dimerization of racemic and optically active 2,3-pentadiene. In: Tetrahedron Letters. Band 11, Nr. 12, 1970, S. 899–902, doi:10.1016/S0040-4039(01)97861-X.
- ↑ a b Marjorie C. Caserio, Meredith C. Findlay, William L. Waters: Stereochemistry of addition reactions of allenes. IV. Stereospecificity of iodination of 2,3-pentadiene. In: The Journal of Organic Chemistry. Band 36, Nr. 2, 1971, S. 275–278, doi:10.1021/jo00801a008.
- ↑ Handbook of Reagents for Organic Synthesis. Wiley, ISBN 978-1-119-95229-9, S. 359 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Larry R. Byrd, Marjorie C. Caserio: Stereochemistry of addition reactions of allenes. III. Free-radical reactions of 2,3-pentadiene and 2-pentyne with tert-butyl hypochlorite. In: Journal of the American Chemical Society. Band 92, Nr. 18, 1970, S. 5422–5431, doi:10.1021/ja00721a022.