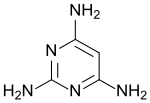
2,4,6-Triaminopyrimidin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4,6-Triaminopyrimidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H7N5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 125,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, wenig löslich in Ethanol und Diethylether[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,4,6-Triaminopyrimidin ist ein Pyrimidin (1,3-Diazin), das in symmetrischer Anordnung drei Aminogruppen trägt und als mögliches präbiotisches Nukleinbasenanalogon postuliert wird.[4] Pyrimidintriamin ist Ausgangsstoff für Haarfärbemittel und Explosivstoffe, insbesondere aber für das Vitamin Folsäure und Arzneistoffe wie Malariamittel, die Cytostatika Aminopterin und Methotrexat, sowie das Diuretikum Triamteren.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1905 berichtete Wilhelm Traube die Synthese von 2,4,6-Triaminopyrimidin aus Malonodinitril und Guanidin in Gegenwart von Natriummethanolat und in Ethanol als Lösungsmittel.[5]
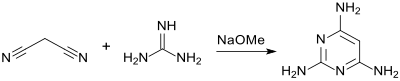
Das Produkt lässt sich aus Lösung als gut kristallisierendes Sulfat isolieren.[5] Bei Einsatz eines besser handhabbaren Guanidinsalzes, z. B. Guanidinhydrochlorid, wird die Base Natriummethanolat zur Erzeugung des freien Guanidins zugegeben.[6] Wegen der Oxidationsempfindlichkeit des aromatischen Triamins muss unter Luftausschluss gearbeitet werden.
Die Synthese von TAP aus an Polystyrol-gebundenem Guanidin im Sinne einer Merrifield-Synthese mit Malodinitril und anschließender Freisetzung mittels Trifluoressigsäure unter Mikrowellenbestrahlung sehr hoher Ausbeute (92 %) und kurzen Reaktionszeiten wurde ebenfalls beschrieben.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines 2,4,6-Triaminopyrimidin liegt als weißer kristalliner Feststoff vor, „der sich beim Umkristallisieren aus heißem, verdünnten Alkohol in langen Nadeln ausscheidet“.[5] Die Substanz bildet an der Luft rasch dunkelbraune Oxidationsprodukte. TAP ist gut löslich in Wasser (36,5 g/kg bei 20 °C) und in Methanol (22,7 g/kg bei 20 °C), weniger gut in Ethanol (4,5 g/kg bei 20 °C).[8]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die spontane Reaktion von 2,4,6-Triaminopyrimidin mit Ribose unter simulierten Bedingungen einer präbiotischen Erde zu einem nukleosidartigen TAP-Ribose-Konjugat, das mit komplementärer Cyanursäure Assoziate bildet, stellt eine Modellreaktion zur Bildung präbiotischer RNA (pre-RNA) dar.[9][10]

2,4,6-Triaminopyrimidin liefert bei Reaktion mit dem Natriumsalz des Nitromalonaldehyds[11] (durch Reaktion von Mucobromsäure[12] mit Salpetriger Säure) eine heteroaromatische Nitroverbindung (A), die in zwei Schritten zu einem Hemmstoff der Dihydrofolatreduktase mit Wirksamkeit gegen Pneumocystis carinii und Toxoplasma gondii.[13][14]

Mit Salpetriger Säure HNO2 lässt sich 2,4,6-Triaminopyrimidin zum 5-Nitrosoderivat (I) umsetzen, das mit Ammoniumsulfid (NH4)2S[5], Natriumdithionit Na2S2O4 [15], Zinkstaub/Salzsäure[16] oder besser durch katalytische Hydrierung an einem Palladium-Kontakt[17] in das u. a. als Entwickler für oxidative Haarfarben[6] verwendete 2,4,5,6-Tetraaminopyrimidin[18] (II) überführt werden kann.

5-Nitroso-2,4,6-triaminopyrimidin (I) ist auch direkt in einer Eintopfreaktion aus den Ausgangsstoffen für TAP ohne dessen Isolierung in sehr guter Ausbeute zugänglich.[6]
In einer frühen Synthesevorschrift für das kaliumsparende Diuretikum Triamteren wird z. B. 5-Nitroso-2,4,6-triaminopyrimidin (I) mit Benzylcyanid[19] in Gegenwart von Natriummethanolat zum Endprodukt cyclisiert.

Die intensive Bearbeitung der Synthese von 2,4,5,6-Tetraaminopyrimidin aus 2,4,6-Triaminopyrimidin in den Jahren 1970–2000 ist auf den hohen Bedarf am Tetramin als Ausgangsstoff für Triamteren und besonders für das Vitamin Folsäure und dessen zur Krebstherapie eingesetzten Antagonisten, wie z. B. Aminopterin und vor allem Methotrexat zurückzuführen.

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu 2,4,6-Triaminopyrimidine bei TCI Europe, abgerufen am 28. November 2022.
- ↑ a b c d Datenblatt 2,4,6-Triaminopyrimidine bei Sigma-Aldrich, abgerufen am 28. November 2022 (PDF).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 271 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ C. Menor Salván, M. Bouza, D.M. Fialho, B. T. Burcar, F. M. Fernández, N. V. Hud: Prebiotic Origin of Pre-RNA Building Blocks in a Urea “Warm Little Pond” Scenario. In: ChemBioChem. Band 21, Nr. 24, 2020, S. 3504–3510, doi:10.1002/cbic.202000510.
- ↑ a b c d W. Traube: Über (2)-Amino-Adenin [(2.6-Diaminopurin]. In: Chem. Ber. Band 37, Nr. 4, 1904, S. 4544–4547, doi:10.1002/cber.19040370454.
- ↑ a b c Patent US4145548: Method for the production of 5-nitroso-2,4,6-triaminopyrimidine. Angemeldet am 10. November 1977, veröffentlicht am 20. März 1979, Anmelder: Henkel KGaA, Erfinder: D. Rose.
- ↑ E.P. Aparna, K.S. Devaky: Microwave assisted solid phase synthesis of trisubstituted pyrimidines. In: J. Chem. Pharm. Res. Band 10, Nr. 8, 2018, S. 67–72 (jocpr.com).
- ↑ Datenblatt 2,4,6-Triaminopyrimidin, 97 % bei Fisher Scientific, abgerufen am 28. November 2022 (PDF).
- ↑ M.C. Chen, B.J. Cafferty, I. Mamajanov, I. Gállego, J. Khanam, R. Krishnamurthy, N. V. Hud: Spontaneous prebiotic formation of a β-ribofuranoside that self-assembles with a complementary heterocycle. In: J. Amer. Chem. Soc. Band 136, Nr. 15, 2013, S. 5640–5646, doi:10.1021/ja410124v.
- ↑ S. Kaur, P. Sharma, S.D. Wetmore: Can Cyanuric Acid and 2,4,6-Triaminopyrimidine Containing Ribonucleosides be Components of Prebiotic RNA? Insights from QM Calculations and MD Simulations. In: ChemPhysChem. Band 20, Nr. 11, 2019, S. 1425–1436, doi:10.1002/cphc.201900237.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Nitromalondialdehyde monohydrate: CAS-Nr.: 34461-00-2, EG-Nr.: 636-459-4, ECHA-InfoCard: 100.164.255, PubChem: 2786779, ChemSpider: 21169750, Wikidata: Q72508036.
- ↑ Paul E. Fanta: Sodium malonaldehyde monohydrate In: Organic Syntheses. 32, 1952, S. 95, doi:10.15227/orgsyn.032.0095; Coll. Vol. 4, 1963, S. 844 (PDF).
- ↑ A. Gangjee, A. Vasudevan, S.F. Queener, R.L. Kisliuk: 2,4-Diamino-5-deaza-6-substituted pyrido[2,3-d]pyrimidine antifolates as potent and selective nonclassical inhibitors of dihydrofolate reductases. In: J. Med. Chem. Band 39, Nr. 7, 1996, S. 1438–1446, doi:10.1021/jm950786p.
- ↑ A. Gangjee, O.O. Adair, M. Pagley, S.F. Queener: N9-Substituted 2,4-Diaminoquinazolines: Synthesis and Biological Evaluation of Lipophilic Inhibitors of Pneumocystis carinii and Toxoplasma gondii Dihydrofolate Reductase. In: J. Med. Chem. Band 51, Nr. 19, 2008, S. 6195–6200, doi:10.1021/jm800694g.
- ↑ Patent US4167633: Preparation of 2,4,5,6-tetraaminopyrimidine from 2,4,6-triaminopyrimidine. Angemeldet am 20. Juli 1977, veröffentlicht am 11. September 1979, Anmelder: The United States of America as represented by the Department of Health, Education and Welfare, Erfinder: T.J. Morrow.
- ↑ Patent US4247693: Process for the preparation of 2,4,5,6-tetraaminopyrimidine sulfate. Angemeldet am 28. September 1979, veröffentlicht am 27. Januar 1981, Anmelder: American Cyanamide Co., Erfinder: P.F. O’Brien, J. Kazan, J.R. Andrade.
- ↑ Patent WO9721711: Process preparing 4-aminopteridine derivatives. Angemeldet am 11. Dezember 1996, veröffentlicht am 19. Juni 1997, Anmelder: Lonza AG, Erfinder: M. Eyer, W. Pfleiderer, S. Taghavi-Moghadam.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,4,5,6-tetraaminopyrimidine: CAS-Nr.: 1004-74-6, EG-Nr.: 213-724-9, ECHA-InfoCard: 100.012.477, PubChem: 70487, ChemSpider: 63662, Wikidata: Q15726087.
- ↑ Patent US3081230: Diuretic and antihypertensive triaminoarylpteridines. Angemeldet am 8. September 1960, veröffentlicht am 12. März 1963, Anmelder: Smith Kline & French Laboratories, Erfinder: J. Weinstock, V.D. Wiebelhaus.
