2,5-Furandicarbaldehyd
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,5-Furandicarbaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H4O3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 124,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Dimethylsulfoxid, Toluol, Cyclohexan, Dichlormethan[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
2,5-Furandicarbaldehyd ist ein fünfgliedriger sauerstoffhaltiger Heteroaromat, der an beiden Kohlenstoffatomen in Nachbarschaft zum Sauerstoffatom je eine Aldehydgruppe trägt. Der Dialdehyd entsteht durch Oxidation der Vorstufe 5-Hydroxymethylfurfural HMF, das als Plattformchemikalie aus nachwachsenden Rohstoffen im Fokus intensiver Forschungsarbeiten steht.[4][5] Für die industrielle Produktion besonders interessant ist die Synthese aus Monosacchariden, wie Fructose oder Glucose bzw. direkt aus Polysacchariden, wie Cellulose oder Lignocellulose.[6] 2,5-Furandicarbaldehyd wurde bereits als Baustein für pharmazeutische Wirkstoffe, Liganden, bifunktionelle Vernetzer und Monomere untersucht.[7]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Synthese aus 5-Hydroxymethylfurfural
[Bearbeiten | Quelltext bearbeiten]Für die Darstellung von 2,5-Diformylfuran aus Hydroxymethylfurfural HMF wurde eine Vielzahl von Oxidationsmitteln vorgeschlagen, die das Zielprodukt möglichst quantitativ, d. h. unter weitgehender Vermeidung der Weiterreaktion zu 5-Formyl-2-furancarbonsäure FFCA und 2,5-Furandicarbonsäure FDCA, erzeugen sollten. Bereits in einer älteren Publikation[8] wurde die Oxidation von HMF mit Bariummanganat BaMnO4 in 1,1,2-Trichlorethan zu 2,5-Diformylfuran in einer Ausbeute von 93 % beschrieben.

Im vorliegenden Fall der Oxidation eines heteroaromatischen Alkohols muss – insbesondere bei den oft erforderlichen hohen Temperaturen (bis > 150 °C) und langen Reaktionszeiten (bis > 10 Stunden) – neben der Überoxidation mit weiteren Nebenreaktionen, wie Decarbonylierung und Polymerisation, gerechnet werden.
Interessant erscheint die (allerdings nur in Millimol-Ansätzen beschriebene) HMF-Oxidation bei Raumtemperatur mit billigem Natriumnitrit NaNO2 in ungiftiger Phosphorsäure, wobei innerhalb einer Stunde DFF in praktisch quantitativer Ausbeute entsteht.[9] Die meisten der verwendeten Oxidations- und Lösungsmittel eignen sich u. a. wegen hoher Kosten, Giftigkeit oder aufwendigen Abtrennung in der Regel nicht für größere Ansätze oder gar für industrielle Verfahren.
Die mit Edelmetallen oder Übergangsmetallverbindungen katalysierte Luft- oder Sauerstoffoxidation von HMF zu DFF ist in dieser Hinsicht vielversprechender und liefert in aprotisch dipolaren Lösungsmitteln, wie z. B. Dimethylsulfoxid DMSO, Dimethylformamid DMF oder Acetonitril bei meist hohen Temperaturen (> 110 °C) bei quantitativem Umsatz an HMF bis zu 99 % 2,5-Diformylfuran.[6] Allerdings sind Reaktionszeiten (> 5 Stunden), Darstellung und Standzeiten der Katalysatoren und Aufwand bei Produktisolierung und -reinigung immer noch unbefriedigend. Die naheliegende Alternative mit Wasser als Reaktionsmedium, in dem sich der Reaktant Hydroxymethylfurfural sehr gut, das Produkt Furan-2,5-dicarbaldehyd kaum löst (< 0,1 Gewichtsprozent bei 25 °C[10]) liefert im Labormaßstab mit nanopartikulärem Titandioxid TiO2 DFF bisher erst in 88%iger Ausbeute.[11])
Synthese aus Fructose
[Bearbeiten | Quelltext bearbeiten]Wegen hoher Kosten aufgrund des hohen Isolierungs- und Reinigungsaufwands und daher geringer Verfügbarkeit eignet sich 5-Hydroxymethylfurfural (noch) nicht als Ausgangsstoff für Furan-2,5-dicarboxaldehyd. Das mittels Amylase z. B. aus billiger Maisstärke zugängliche Monosaccharid D-Glucose wird großtechnisch in D-Fructose isomerisiert, die durch dreifache Wasserabspaltung im Sauren in Hydroxymethylfurfural übergeht. Die Reaktion wird meist in Dimethylsulfoxid ausgeführt, da DMSO ein gutes Lösungsmittel für Fructose[12] ist (die dabei überwiegend als fünfgliedrige β-Furanose vorliegt) und Nebenreaktionen des HMF unterdrückt.[2]

Die HMF-haltige Lösung wird ohne Aufarbeitung als Eintopfreaktion direkt zu DFF oxidiert, wobei ebenfalls meist DMSO als Lösungsmittel zum Einsatz kommt.[6] Für technisch brauchbare Verfahren eignet sich nur die katalytische Oxidation mit Sauerstoff oder Luft. Als heterogene Oxidationskatalysatoren werden meist Vanadium-, Eisen- oder Molybdänverbindungen eingesetzt. Die Eintopfreaktionen werden, ausgehend von Fructoselösungen, einstufig: also Dehydratisierung und Oxidation parallel oder zweistufig: z. B. Dehydratisierung unter Stickstoffatmosphäre und anschließend Oxidation unter Sauerstoffatmosphäre sequentiell, ausgeführt.
In einem einstufigen Prozess konnte DFF mit einem Vanadium-Zeolith-Katalysator bei vollständigem Umsatz des Ausgangsmaterials Fructose mit 86%iger Ausbeute dargestellt werden.[13] Zweistufig wurden mit einem eisenhaltigen Mil-88B-Metal Organic Framework MOF in Ethanol bei quantitativem Fructoseumsatz DFF in einer Ausbeute von >99 % erzeugt.[14]
Synthese aus Cellulose bzw. Lignocellulose
[Bearbeiten | Quelltext bearbeiten]Wie bei allen aus Biomasse abgeleiteten Plattformchemikalien wäre das preisgünstigste Ausgangsmaterial für die industrielle Herstellung von 2,5-Diformylfuran Cellulose oder noch besser Lignocellulose. Allerdings sind deren Unlöslichkeit in herkömmlichen Lösungsmitteln und deutlich schlechtere DFF-Ausbeuten bei Glucose als Zwischenprodukt enorme Hindernisse. Die bisher beschriebenen Prozessbedingungen zur Herstellung des Schlüsselrohstoffs HMF[15], z. B. Reaktionstemperaturen > 150 °C, mehrstündige Reaktionszeiten, Schwermetallsalze wie Chrom(III)chlorid CrCl3 als Katalysatoren und Reaktionsmedien, wie z. B. ionischen Flüssigkeiten, eignen sich noch nicht für großtechnische Verfahren.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2,5-Diformylfuran ist eine kristalline Substanz, die bei der Synthese als weißes Pulver oder in Form langer Nadeln anfällt.[2] Der Dialdehyd ist in Wasser praktisch unlöslich, aber löslich in vielen organischen Lösungsmitteln und dadurch leicht aus Stoffgemischen extrahierbar. Die bei der Reinigung durch Vakuumsublimation und anschließende Soxhlet-Extraktion gebildeten Kristallnadeln sind oxidationsstabil.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Erhitzen auf 200 °C in Gegenwart eines Palladium-Kontakts decarbonyliert Furan-2,5-dialdehyd quantitativ zu Furan (50 %) und Furfural (48 % Ausbeute).[16]

Der Dialdehyd DFF wird als Monomer für Polyimide und Phenolharze diskutiert, in denen es den allerdings technisch unbedeutenden Terephthalaldehyd bzw. Isophthalaldehyd ersetzen könnte.[17]
Das Bis-Oxim des Furan-2,5-carbaldehyds kann an sauren Ionenaustauschern in 82%iger Ausbeute zu 2,5-Dicyanofuran dehydratisiert werden,[18]

das als Baustein für pharmazeutische Wirkstoffe oder als Monomer für Polymere diskutiert wird.
Oxidation von 2,5-Diformylfuran führt über 5-Formyl-2-furancarbonsäure (FFCA) zur 2,5-Furandicarbonsäure (FDCA), die als Ersatz für Terephthalsäure im biobasierten, aber nicht bioabbaubaren Polyester Polyethylenfuranoat (PEF) Verwendung findet.[19]

Der kommerzielle Erfolg des mit großen Vorschusslorbeeren bedachten PEF lässt derzeit noch auf sich warten.
Die reduktive Aminierung von DFF mit Ammoniak NH3 führt zum intermediären Zwischenprodukt Di-Aldimin, das sehr stark zur Oligomerisierung neigt. Bei sehr großem NH3-Überschuss kann mit Raney-Nickel 2,5-Bis(aminomethyl)furan (BAMF) in einer Ausbeute von 42 % erhalten werden.[20]
BAMF ist wesentlich besser über das Bis-Oxim[8] an einem Rhodium-Katalysator in 94%iger Ausbeute zugänglich.[18]

Aus diesem primären Diamin können biobasierte Polyamide[21] oder Polyurethane hergestellt werden.
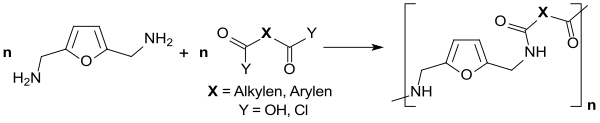
Andere Polymere mit 2,5-Diformylfuran als Monomer, wie z. B. in Polykondensaten mit Harnstoff, besitzen hingegen keine vielversprechenden Eigenschaften.[22]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu 2,5-Diformylfuran bei TCI Europe, abgerufen am 27. Juli 2019.
- ↑ a b c d Patent EP1427715B1: Process for preparing 2,5-diformylfuran from carbohydrates. Angemeldet am 17. September 2002, veröffentlicht am 17. Mai 2006, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: V. Grushin, N. Herron, G.A. Halliday.
- ↑ a b c Datenblatt 2,5-Furandicarbaldehyd bei Sigma-Aldrich, abgerufen am 28. Juli 2019 (PDF).
- ↑ R.-J. van Putten, J.C. van der Waal, E. de Jong, C.B. .B. Rasrendra, H.J. Heeres, J.G. de Vries: Hydroxymethylfurfural, a versatile platform chemical made from renewable resources. In: Chem. Rev. Band 113, Nr. 3, 2013, S. 1499–1597, doi:10.1021/cr300182k.
- ↑ T. Wang, M.W. Nolte, B.H. Shanks: Catalytic dehydration of C6 carbohydrates for the production of hydroxymethylfurfural (HMF), as a versatile platform chemical. In: Green Chem. Band 16, Nr. 2, 2014, S. 548–572, doi:10.1039/C3GC41365a.
- ↑ a b c P.Pal, S. Saravanamutugan: Recent Advances in the Development of 5-Hydroxymethylfurfural Oxidation with Base (Nonprecious)-Metal-Containing Catalysts. In: ChemSusChem. Band 12, Nr. 1, 2019, S. 145–163, doi:10.1002/cssc.201801744.
- ↑ Synthesis, chemistry and applications of 5-hydroxymethylfurfural and its derivatives; J. Lewkowski, Arkivoc, 2001(i), 128–152 (PDF).
- ↑ a b T. El-Hajj, A. Masroua, J.C. Martin, G. Descotes: Synthèse de l’hydroxyméthyl-5 furanne carboxaldéhyde-2 et de ses dérivés par traitement acide de sucres sur résines échangeuses d‘ions. In: Bull. Soc. Chim. Fr. Band 5, 1987, S. 855–860, doi:10.1134/s1070428018030077.
- ↑ N.V. Smirnova, V.A. Klushin, T.V. Bezbozhnaya, E.V. Khomutova, V.L. Lobachev, S.A. Mitchenko: Selective oxidation of 5-(hydroxymethyl)furfural to furan-2,5-dicarbaldehyde with sodium nitrite in phosphoric acid. In: Russ. J. Org. Chem. Band 54, Nr. 3, 2018, S. 414–418, doi:10.1134/s1070428018030077.
- ↑ S. Gajula, K. Inthumathi, S.R. Arumugam, K. Srinivasan: Strategic designing on selection of solvent systems for conversion of biomass sugars to furan derivatives and their separation. In: ACS Sustain. Chem. Eng. Band 5, Nr. 6, 2017, S. 5373–5381, doi:10.1021/acssuschemeng.7b00681.
- ↑ D. Gupta, K.K. Pant, B. Saha: Titania nanoparticles embedded in functionalized carbon for the aqueous phase oxidation of 5-hydroxymethylfurfural. In: Mol. Catal. Band 435, 2017, S. 182–188, doi:10.1016/j.mcat.2017.03.028.
- ↑ L. Shuai, J. Luterbacher: Organic solvent effect in biomass conversion reactions. In: ChemSusChem. Band 9, Nr. 2, 2016, S. 133–155, doi:10.1002/cssc.201501148.
- ↑ W. Zhang, W. Hou, T. Meng, W. Zhuang, J. Xie, Y. Zhou, J. Wang: Direct synthesis of V-containing all-silica beta-zeolite for efficient one-pot, one-step conversion of carbohydrates into 2,5-diformylfuran. In: Catal. Sci. Technol. Band 7, Nr. 24, 2017, S. 6050–6058, doi:10.1039/C7CY01834G.
- ↑ R. Fang, R. Luque, Y. Li: Efficient one-pot fructose to DFF conversion using sulfonated magnetically separable MOF-derived Fe3O4 (111) catalysts. In: Green Chem. Band 19, Nr. 3, 2017, S. 647–655, doi:10.1039/C6GC02018F.
- ↑ F. Menegazzo, E. Ghedini, M. Signoretto: 5-Hydroxymethylfurfural (HMF) Production from Real Biomasses. In: Molecules. Band 23, Nr. 1, 2018, S. 1–18, doi:10.3390/molecules23092201.
- ↑ Patent US20130317192A1: Processes for preparing diacids, dialdehydes and polymers. Angemeldet am 25. Juli 2013, veröffentlicht am 28. November 2013, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: V. Grushin, L.E. Manzer, W. Partenheimer.
- ↑ I. Delidovich, P.J.C. Hausoul, L. Deng, R. Pfützenreuter, M. Rose, R. Palkovits: Alternative monomers based on lignocellulose and their use for polymer production. In: Chem. Rev. Band 116, Nr. 3, 2016, S. 1540–1599, doi:10.1021/acs.chemrev.5b00354.
- ↑ a b Y. Xu, X. Jia, J. Ma, J. Gao, F. Xia, X. Li, J. Xu: Selective synthesis of 2,5-bis(aminomethyl)furan via enhancing the catalytic dehydration–hydrogenation of 2,5-diformylfuran dioxime. In: Green Chem. Band 20, Nr. 12, 2018, S. 2697–2701, doi:10.1039/C8GC00947C.
- ↑ Polyethylene Furanoate (PEF) - The Rising Star Amongst Today's Bioplastics. Omnexus - Specialchem, 31. Juli 2018, abgerufen am 8. August 2019.
- ↑ N.-T. Le, A. Byun, Y. Han, K.-I. Lee, H. Kim: Preparation of 2,5-Bis(aminomethyl)furan by direct reductive amination of 2,5-diformylfuran over nickel-raney catalysts. In: Green and Sustainable Chemistry. Band 5, 2015, S. 115–127, doi:10.4236/gsc.2015.53015.
- ↑ Patent WO2017005812A1: Herstellung eines Polyamids, das 2,5-Bis(aminomethyl)furan enthält. Angemeldet am 6. Juli 2016, veröffentlicht am 12. Januar 2017, Anmelder: BASF SE, Erfinder: G.J.M. Habraken, J.K. Sprafke, M. da Silva.
- ↑ A.S. Amarasekara, D. Green, L.D. Williams: Renewable resources based polymers: Synthesis and characterization of 2,5-diformylfuran–urea resin. In: Eur. Polym. J. Band 45, Nr. 2, 2009, S. 595–598, doi:10.1016/j.eurpolymj.2008.11.012.
