2,6-Dibromphenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,6-Dibromphenol | ||||||||||||||||||
| Summenformel | C6H4Br2O | ||||||||||||||||||
| Kurzbeschreibung |
weißliches kristallines Pulver mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 251,9 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
6,67 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit |
gering wasserlöslich[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,6-Dibromphenol ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Halogenaromaten zählt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]2,6-Dibrombenzol kann durch Bromierung von 4-Hydroxybenzoesäure mit Brom in Schwefelsäure bei 0 °C und anschließender Decarboxylierung der 3,5-Dibrom-4-hydroxybenzoesäure[4] hergestellt werden.[5]
Derivate
[Bearbeiten | Quelltext bearbeiten]Der Methylether kann durch Methylierung mit Iodmethan und Natriummethanolat hergestellt werden und ist auch unter dem Trivialnamen 2,6-Dibromanisol bekannt.[5] Sein Schmelzpunkt liegt bei 13 °C, sein Siedepunkt bei 34 mmHg bei 143–145 °C.[2]
Der Ethylether 1,3-Dibrom-2-ethoxybenzol schmilzt bei 40,5 °C.[2]
Veresterung mit Essigsäureanhydrid liefert das Acetat, das bei 46 °C schmilzt (CAS-Nummer: 28165-72-2).[2]
Weitere Bromierung von 2,6-Dibromphenol mit Brom in Kaliumbromid-Lösung liefert 2,4,6-Tribromphenol, das seinerseits mit Brom zum 2,4,4,6-Tetrabrom-2,5-cyclohexadienon weiterreagiert[6]. Diese Reaktion kann durch Iodwasserstoff umgekehrt werden.[7]
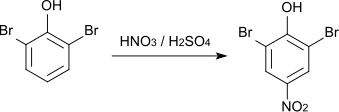
Die Nitrierung von 2,6-Dibromphenol mit Salpetersäure liefert 2,6-Dibrom-4-nitrophenol[8] (Schmelzpunkt 144–145 °C[9]).[10]
Vorkommen in der Natur
[Bearbeiten | Quelltext bearbeiten]2,6-Dibromphenol wurde in den Meereswürmern Balanoglossus biminiensis nachgewiesen.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 2,6-Dibromphenol bei Alfa Aesar, abgerufen am 2. August 2010 (Seite nicht mehr abrufbar).
- ↑ a b c d e f g Dictionary of organic compounds, S. 1971 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt 2,6-Dibromophenol bei Sigma-Aldrich, abgerufen am 19. März 2011 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3,5-Dibrom-4-hydroxybenzoesäure: CAS-Nr.: 3337-62-0, EG-Nr.: 222-075-0, ECHA-InfoCard: 100.020.069, PubChem: 76857, ChemSpider: 69309, Wikidata: Q27105450.
- ↑ a b Frank George Pope, Arthur Samuel Wood: CXCIII.—The Bromination of Phenol. 2 : 4- and 2 : 6-Dibromophenol. In: Journal of the Chemical Society, Transactions. Band 101, 1912, S. 1823–1829, doi:10.1039/CT9120101823.
- ↑ John A. Price: "The Structure of Tribromophenol bromide", in: J. Am. Chem. Soc., 1955, 77 (20), S. 5436–5437; doi:10.1021/ja01625a081.
- ↑ Hans P. Latscha, Helmut A. Klein, Gerald W. Linti: "Analytische Chemie: Chemie-Basiswissen III", S. 287 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,6-Dibrom-4-nitrophenol: CAS-Nr.: 99-28-5, EG-Nr.: 202-744-3, ECHA-InfoCard: 100.002.495, PubChem: 7429, ChemSpider: 7151, Wikidata: Q72464687.
- ↑ W. W. Hartman, J. B. Dickey: 2,6-Dibromo-4-nitrophenol In: Organic Syntheses. 15, 1935, S. 6, doi:10.15227/orgsyn.015.0006; Coll. Vol. 2, 1943, S. 173 (PDF).
- ↑ F. G. Pope, A. S. Wood: "CXCIII.—The bromination of phenol. 2 : 4- and 2 : 6-dibromophenol" in J. Chem. Soc., Trans. 1912, 101, S. 1823–1829. doi:10.1039/CT9120101823