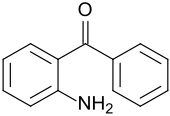
2-Aminobenzophenon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Aminobenzophenon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H11NO | |||||||||||||||
| Kurzbeschreibung |
gelber[1] kristalliner Feststoff bzw. blass- bis dunkelgelbes Kristallpulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 197,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Methanol und Dimethylsulfoxid[4][5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
2-Aminobenzophenon weist neben einer aromatische Ketongruppe eine Aminogruppe auf und dient als Ausgangsstoff für viele benzoanellierte Heterocyclen, sowie für Pestizide, pharmazeutische Arzneistoffe und Pigmente.
Vorkommen und Darstellung
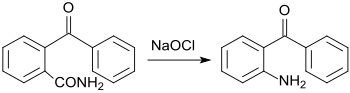
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1894 berichteten Carl Graebe und Fritz Ullmann die Synthese von o-Aminobenzophenon durch Hofmann-Umlagerung von o-Benzoylbenzoesäureamid mit aus Brom im Alkalischen gebildeten Natriumhypobromit.[6][7] Von Hans-Jürgen Quadbeck-Seeger und Mitarbeiter stammt eine Variante des Hofmann-Abbaus mit Natriumhypochlorit, wobei 2-Aminobenzophenon in 98%iger Ausbeute erhalten wird.[8]
Eine dreistufige Synthese von 2-Benzoylanilin, ausgehend von 2-Nitrobenzylchlorid, wurde kurz darauf von Siegmund Gabriel beschrieben.[9]
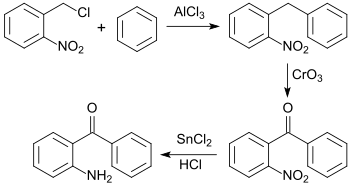
In einer Friedel-Crafts-Alkylierung wird dabei 2-Nitrobenzylchlorid mit Benzol umgesetzt, die Methylengruppe mit Chromtrioxid CrO3 zur Ketongruppe oxidiert und die aromatische Nitrogruppe mit Zinn(II)-chlorid SnCl2 zum Amin reduziert. Die Gesamtausbeute über alle Stufen betrug ca. 54 %.
Ein Standardverfahren geht aus von preisgünstiger Anthranilsäure, die nach Schutz der Aminogruppe mit Tosylchlorid mit Phosphorpentachlorid zum Säurechlorid umgesetzt wird, das mit Benzol in einer Friedel-Crafts-Acylierung zum geschützten Benzophenon reagiert.[10]
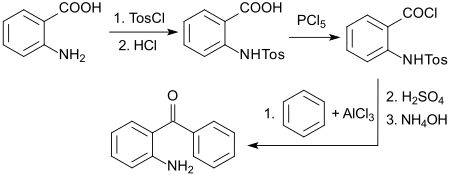
Die Tosylgruppe wird mit starken Säuren, wie z. B. konzentrierter Schwefelsäure oder Salzsäure[11] abgespalten und die Aminofunktion mit Ammoniumhydroxid freigesetzt. Die Gesamtausbeute beträgt 54 %.
Eine Reihe von Alternativrouten ist in der Literatur beschrieben,[12] die sich aber wegen teurer Reaktanden, mehrstufiger Reaktionsfolgen und geringer Ausbeuten nicht durchgesetzt haben.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Aminobenzophenon ist ein gelber kristalliner Feststoff, der in Wasser praktisch unlöslich ist und sich in Methanol, heißem Ethanol und DMSO löst.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Das Diazoniumsalz von 2-Aminobenzophenon kann mit Kupfer in einer Pschorr-Cyclisierung zu Fluorenon cyclisiert werden.[6]

Benzoanellierte Heterocyclen aus 2-Aminobenzophenon
[Bearbeiten | Quelltext bearbeiten]In frühen Arbeiten von C. Graebe und S. Gabriel wurde bereits die Darstellung benzoanellierter Stickstoff-Heterocyclen aus 2-Aminobenzophenon beschrieben, wie z. B. das Acridin-Derivat Acridon[6] durch Oxidation mit Blei(IV)-oxid PbO2
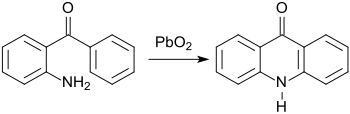
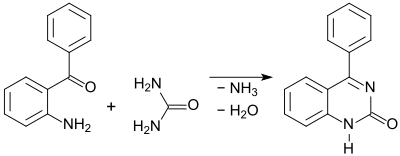
und das Chinazolin-Derivat 4-Phenylchinazolin-2-on[9] durch Reaktion mit Harnstoff.
Stellungsisomere Acridone werden bei der säurekatalysierten Umsetzung von 2-Aminobenzophenon mit 1,3-Diketonen, wie z. B. 1,3-Cyclohexandion erhalten.[13]

Sauerstofffreie Chinazoline sind in hohen Ausbeuten bis 95 % durch Reaktion von 2-Aminobenzophenon mit Benzylaminen und Oxidation mit Iod/tert-Butylhydroperoxid I2/TBHP[14]

oder mit Benzaldehyden und Ammoniumacetat in Gegenwart ionischer Flüssigkeiten (engl. ionic liquids IL) zugänglich.[15] Die intermediär entstehenden 1,2-Dihydrochinazoline[16] werden auch durch Luftsauerstoff zu Chinazolinen oxidiert.
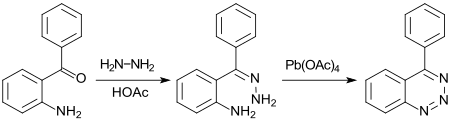
In neuerer Zeit wurden auch stickstoffhaltige benzoanellierte Heterocyclen mit drei Stickstoffatomen, wie 1,2,3-Benzotriazine, über das entsprechende Hydrozon und dessen Oxidation mit Blei(IV)-acetat synthetisiert.[17]
Pharmakologisch aktive Wirkstoffe aus 2-Aminobenzophenon
[Bearbeiten | Quelltext bearbeiten]2-Benzoylanilin wird als Ausgangsstoff für Benzodiazepine, wie z. B. Nitrazepam MogadanR [18] eingesetzt.
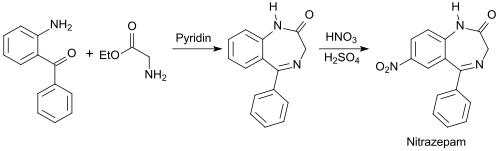
während die Herstellung von Chlordiazepoxid LibriumR [19] von 2-Amino-5-chlorbenzophenon ausgeht.
Das Antihistaminikum Epinastin kann in einer mehrstufigen Synthese aus 2-Aminobenzophenon erhalten werden.[20]
Pigmente aus 2-Aminobenzophenon
[Bearbeiten | Quelltext bearbeiten]Die Reaktion von Diethylsuccinylosuccinat mit 2-Aminobenzophenon liefert in einer säurekatalysierten Friedlaender-Kondensation ein blassgelbes Kondensationsprodukt, das mit Chloranil zu einer violetten Zwischenstufe oxidiert wird, die beim Erhitzen ein metallisch grünes unlösliches Pigment ergibt.[21]

Eine Reaktionsvariante[22] unterwirft das lösliche Kondensationsprodukt direkt einer oxidativen Cyclisierung bei hoher Temperatur (255 °C), wobei das Tetrabenzodiazaketoperylen-Pigment als schwarzer kristalliner Feststoff in 95 % Ausbeute anfällt. Pigmentpräparationen der Verbindung zeigen lichtstabile dunkelviolette bis schwarze Farbtöne.
Mit 1,2-Diiodbenzol reagiert 2-Aminobenzophenon in einer Ullmann-Reaktion in Gegenwart von Kaliumcarbonat und Kupfer zu einem gelben Dibenzophenanthrolin-Pigment.[23]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt 2-Aminobenzophenon bei Sigma-Aldrich, abgerufen am 15. März 2019 (PDF).
- ↑ a b c Eintrag zu 2-Aminobenzophenone bei TCI Europe, abgerufen am 15. März 2019.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2016, ISBN 978-0-323-28659-6, S. 322.
- ↑ a b c Datenblatt 2-Aminobenzophenone bei Alfa Aesar, abgerufen am 15. März 2019 (Seite nicht mehr abrufbar).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–32.
- ↑ a b c C. Graebe, F. Ullmann: Darstellung von o-Aminobenzophenon und Synthese von Acridon. In: Ber. Dtsch. Chem. Ges. Band 27, Nr. 3, 1894, S. 3483–3484, doi:10.1002/cber.189402703170.
- ↑ C. Graebe, F. Ullmann: Ueber o-Aminobenzophenon. In: Liebigs Ann. Chem. Band 291, Nr. 1–2, 1896, S. 8–16, doi:10.1002/jlac.18962910103.
- ↑ Patent US4082749: Process for the production of amines. Angemeldet am 3. Juni 1974, veröffentlicht am 4. April 1978, Anmelder: BASF AG, Erfinder: H.-J. Quadbeck-Seeger.
- ↑ a b S. Gabriel, R. Stelzner: Zur Kenntnis der Chinazolinverbindungen. In: Ber. Dtsch. Chem. Ges. Band 29, Nr. 2, 1896, S. 1300–1316, doi:10.1002/cber.18960290226.
- ↑ H.J. Scheifele, Jr., D.F. DeTar: 2-Aminobenzophenone In: Organic Syntheses. 32, 1952, S. 8, doi:10.15227/orgsyn.032.0008; Coll. Vol. 4, 1963, S. 34 (PDF).
- ↑ Patent US6310249B1: Process for producing 2-aminobenzophenone compound. Angemeldet am 22. Juli 1999, veröffentlicht am 30. Oktober 2001, Anmelder: Nissan Chemical Industries, Ltd., Erfinder: H. Matsumoto, T. Horiuchi.
- ↑ D.A. Walsh: The Synthesis of 2-Aminobenzophenones. In: Synthesis. Band 9, 1980, S. 677–688, doi:10.1055/s-1980-29169.
- ↑ L.J. Kumar, S. Sarveswari, V. Vijayakumar: DMFDMA catalyzed synthesis of 2-((Dimethylamino)methylene)-3,4-dihydro-9arylacridin-1(2H)-ones and their derivatives: invitro antifungal, antibacterial and antioxidant evaluations. In: Open Chem. Band 16, 2018, S. 1077–1088, doi:10.1015/chem-2018-0110.
- ↑ J. Zhang, D. Zhu, C. Yu, C. Wan, Z. Wang: A simple and efficient approach to the synthesis of 2-phenylquinazolines via sp3 C–H functionalization. In: Org. Lett. Band 12, Nr. 12, 2010, S. 2841–2843, doi:10.1021/ol100954x.
- ↑ S.K. Panja, S. Saha: Recyclable, magnetic ionic liquid bmim[FeCl4]-catalyzed, multicomponent, solvent-free, green synthesis of quinazolines. In: RSC Adv. Band 3, 2013, S. 14495–14500, doi:10.1039/c3ra42039f.
- ↑ C. Derabli, R. Boulcina, G. Kirsch, B. Carboni, A. Debache: A DMAP-catalyzed mild and efficient synthesis of 1,2-dihydroquinazolines via a one-pot three-component protocol. In: Tetrahedron Lett. Band 55, Nr. 1, 2014, S. 200–204, doi:10.1016/j.tetlet.2013.10.157.
- ↑ B.M. Adger, S. Bradbury, M. Keating, C.W. Rees, R.C. Storr, M.T. Williams: 1,2,3-Benzotriazines. In: J. Chem. Soc., Perkin Trans. 1. Band 0, Nr. 1, 1975, S. 31–40, doi:10.1039/P19750000031.
- ↑ Patent DE2252378: Verfahren zur Herstellung von Benzodiazepin-Derivaten. Angemeldet am 25. Oktober 1972, veröffentlicht am 24. Mai 1973, Anmelder: F. Hoffmann-La Roche & Co., AG, Erfinder: H. Boemches, H. Meyer.
- ↑ Patent US2893992: 1,4-Benzodiazepine 4-oxides. Angemeldet am 15. Mai 1958, veröffentlicht am 7. Juli 1959, Anmelder: F. Hoffmann-La Roche Inc., Erfinder: Leo Sternbach.
- ↑ Patent CN103012408A: Synthesis method of epinastin. Angemeldet am 28. November 2012, veröffentlicht am 3. April 2013, Anmelder: Guangzhou Inst. Biomed & Health, Erfinder: Q. Cai, J. Liu.
- ↑ K. Kitahara, H. Nishi: New heterocyclic compounds derived from diethyl 2,5‐dioxo‐1,4‐cyclohexanedicarboxylate and 2‐aminobenzophenone. In: J. Heterocycl. Chem. Band 25, Nr. 4, 1988, S. 1063–1065, doi:10.1002/jhet.5570250403.
- ↑ Patent US5028643: Tetrabenzodiazaketoperylene pigment. Angemeldet am 27. Juni 1989, veröffentlicht am 2. Juli 1991, Anmelder: Ciba-Geigy Corp., Erfinder: E.E. Jaffe.
- ↑ D. Hellwinkel, P. Ittemann: Eine allgemeine Synthesemethode für Dibenzo[b,j][x,z]phenanthroline mit x,z = 1,7; 4,7 und 1,10. In: Liebigs Ann. Chem. Band 1985, Nr. 7, 1985, S. 1501–1507, doi:10.1002/jlac.198519850722.
