Aminopyridine
Die Aminopyridine bilden in der Chemie eine Stoffgruppe von organischen Verbindungen, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie bestehen aus einem Pyridinring, der mit einer Aminogruppe (–NH2) substituiert ist. Aufgrund der unterschiedlichen Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C5H6N2. Im weiteren Sinne werden auch andere Verbindungen mit Aminogruppe am Pyridinring als Aminopyridine bezeichnet.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Aminopyridine | ||||||||||
| Name | 2-Aminopyridin | 3-Aminopyridin | 4-Aminopyridin | |||||||
| Andere Namen | α-Aminopyridin o-Aminopyridin 2-Pyridylamin |
β-Aminopyridin m-Aminopyridin 3-Pyridylamin |
γ-Aminopyridin p-Aminopyridin 4-Pyridylamin Fampridin (INN) Dalfampridine (USAN) | |||||||
| Strukturformel | 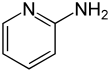
|

|

| |||||||
| CAS-Nummer | 504-29-0 | 462-08-8 | 504-24-5 | |||||||
| PubChem | 10439 | 10009 | 1727 | |||||||
| Summenformel | C5H6N2 | |||||||||
| Molare Masse | 94,12 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Kurzbeschreibung | farblose bis gelbliche, brennbare Kristalle mit unangenehmem Geruch | |||||||||
| Schmelzpunkt | 55–58 °C[1] | 60–63 °C[2] | 158 °C[3] | |||||||
| Siedepunkt | 209–211 °C[1] | 250–252 °C[2] | 274 °C[3] | |||||||
| pKs-Wert (der konjugierten Säure BH+) |
6,71[4] | 6,03[4] | 9,114[4] | |||||||
| Dichte | 1,26 g·cm−3[3] | |||||||||
| Löslichkeit | löslich in Wasser und Alkohol | |||||||||
| GHS- Kennzeichnung |
|
|
| |||||||
| H- und P-Sätze | 301+311‐314‐412 | 301‐311‐315‐319‐410 | 300‐311‐331‐314‐411 | |||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||
| 260‐273‐280‐303+361+353 304+340+310‐305+351+338 |
264‐273‐280‐301+310+330 302+352+312‐391 |
? | ||||||||
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Aminopyridine sind farblose bis gelbliche Feststoffe mit einem pyridinartigen Geruch. Sie sind löslich in Wasser und Alkoholen. Das 4-Aminopyridin, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]4-Aminopyridin wird zur Herstellung von 4-Halogenpyridinen und Arzneimitteln verwendet. Es selbst dient als Vogelgift[5] und in der Medizin als reversibler Kaliumkanalblocker (z. B. bei Multipler Sklerose).[6]
4-Aminopyridin wurde 2010 von der US-amerikanischen Arzneimittelbehörde unter dem US-amerikanischen Freinamen (USAN) Dalfampridine zur unterstützenden Behandlung der Multiplen Sklerose zugelassen.[7] Ein entsprechender Antrag für die Europäische Union wurde jedoch aufgrund eines ungenügenden Nutzen-Risiko-Verhältnisses vorläufig abgewiesen.[8] Eine Entscheidung der Schweizer Behörde steht noch aus.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu 2-Aminopyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 3-Aminopyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu 4-Aminopyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ US Environmental Protection Agency (27. September 2007): Reregistration Eligibility Decision for 4-aminopyridine. EPA 738-R-07-013. (PDF; 917 kB) Zugegriffen am 2. Februar 2011.
- ↑ Goodman AD, Brown TR, Krupp LB, Schapiro RT, Schwid SR, Cohen R, Marinucci LN, Blight AR: Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. In: The Lancet, 373, 2009, S. 732–738; PMID 19249634.
- ↑ U.S. Food and Drug Administration. FDA Approves Ampyra to Improve Walking in Adults with Multiple Sclerosis (FDA News Release vom 22. Januar 2010). Abgerufen am 26. Januar 2010.
- ↑ Europäische Arzneimittelagentur (20. Januar 2011): Refusal of the marketing authorisation for Fampyra (fampridine). ( vom 21. Juni 2018 im Internet Archive) (PDF; 51 kB) Zugegriffen am 30. Januar 2011.


