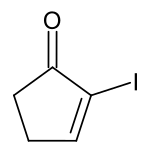
2-Iodcyclopent-2-enon
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 2-Iodcyclopent-2-enon | ||||||||||||
| Summenformel | C5H5IO | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 207,997 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
70,5–71 °C[1] | ||||||||||||
| Löslichkeit |
löslich in Acetonitril[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
2-Iodcyclopent-2-enon ist eine chemische Verbindung aus der Gruppe der cyclischen Alkenone.
Darstellung
[Bearbeiten | Quelltext bearbeiten]2-Iodcyclopent-2-enon kann auf direktsynthetische Art aus Cyclopentenon und Iod hergestellt werden.[3] Dazu werden die beiden Edukte in einer wässrigen THF-Lösung mit DMAP als Katalysator und einer Base wie Kaliumcarbonat aufgelöst und einige Zeit bei Raumtemperatur gerührt. Schon nach einer Stunde ist der Umsatz vollständig. Der dabei ablaufende Reaktionsmechanismus entspricht dem der Baylis-Hillman-Reaktion.[4] Somit wird das eingesetzte Diiod formal in ein Iodid-Ion und ein Iodonium-Ion gespalten und muss daher im Überschuss zugesetzt werden. Die Reaktion lässt sich auf andere α,β-ungesättigte Ketone übertragen, liefert aber außer für die Edukte Cyclopentenon und Cyclohexenon nur in wenigen Fällen vollständigen Umsatz.
Eine frühere Synthese geht ebenfalls von Cyclopentenon aus, setzt aber das gefährliche Iodazid als Iodierungsreagenz ein.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In der 2-Position können Stille-Kupplungen durchgeführt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d J. M. McIntosh: Reaction of Iodine Azide with Cyclopentenone and Cyclohexenone. In: Canadian Journal of Chemistry. Band 49, 1971, S. 3045–3047.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ M. E. Kraft, J. W. Cran: A Convenient Protocol for the a-Iodination of a,b-Unsaturated Carbonyl Compounds with I2 in an Aqueous Medium. In: Synlett. Band 2005, Nr. 8, 2005, S. 1263–1266, doi:10.1055/s-2005-868495.
- ↑ Thomas Laue, Andreas Plagens: Namens- und Schlagwort-Reaktionen. der Organischen Chemie. 4. Auflage. Teubner Studienbücher, 1994, ISBN 3-519-33526-3, S. 34.