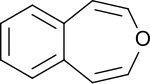
3-Benzoxepin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | 3-Benzoxepin | |||||||||
| Summenformel | C10H8O | |||||||||
| Kurzbeschreibung |
zitronengelber[1] Feststoff | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 144,17 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in unpolaren Lösungsmitteln, wie Diethylether, Benzol und Tetrachlormethan[3], sowie Alkoholen, wie z. B. Methanol[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
3-Benzoxepin ist ein anelliertes Ringsystem aus einem aromatischen Benzolring und dem nicht-aromatischen, ungesättigten sauerstoffhaltigen siebengliedrigen Heterocyclus Oxepin, dessen Synthese von Karl Dimroth und Mitarbeitern im Jahr 1961 berichtet wurde.[1]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]3-Benzoxepin kommt nicht natürlich vor, sein bicyclisches Ringsystem findet sich aber in den Naturstoffen Perilloxin (I) aus Perilla (Perilla frutescens), Acuta[5] und Tenual (II) bzw. Tenucarb (III) aus Asphodeline tenuior.[6]

Darstellung
[Bearbeiten | Quelltext bearbeiten]Bei der Darstellung von unsubstituiertem 3-Benzoxepin nach Karl Dimroth wird in einer doppelten Wittig-Reaktion Phthalaldehyd[7] mit Bis(α,α′-triphenylphosphonium)dimethyletherdibromid,[2] – aus α,α′-Dibromdimethylether [Bis(brommethyl)ether (BBME), zugänglich aus Bromwasserstoffsäure und Paraformaldehyd in 97%iger Ausbeute][8] und Triphenylphosphin – mit Natriummethanolat in trockenem Methanol in 55%iger Ausbeute erhalten.[1][3]

UV-Bestrahlung von Naphthalinderivaten, wie z. B. 1,4-Epoxy-1,4-dihydronaphthalin[9]

oder Photooxidation von 1,4-Dihydronaphthalin und anschließende Pyrolyse des entstehenden Hydroperoxids.[10]

liefert ebenfalls in geringen Mengen (Ausbeuten 4–6 %) 3-Benzoxepin.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Benzoxepin ist ein in zitronengelben Blättchen kristallisierender Feststoff, der Naphthalin in Geruch und leichter Sublimierbarkeit ähnelt. Die Substanz löst sich in unpolaren organischen Lösungsmitteln und kann wie Naphthalin durch Sublimation gereinigt werden. 3-Benzoxepin ist relativ säurestabil; erst beim Kochen mit konzentrierter alkoholischer Salzsäure entsteht ein ungesättigter Aldehyd, bei dem es sich wahrscheinlich um Inden-3-aldehyd handelt. Die katalytische Hydrierung mit Palladium liefert 1,2,4,5-Tetrahydro-3-benzoxepin.

Chlor und Brom werden zu undefinierten Dihalogeniden addiert, aus denen durch Zinkstaubdestillation 3-Benzoxepin zurückerhalten wird.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d K. Dimroth, G. Pohl: 3-Benzoxepin. In: Angew. Chem. Band 73, Nr. 12, 1961, S. 436, doi:10.1002/ange.19610731215.
- ↑ a b c K. Dimroth, G. Pohl, H. Follmann: Die Synthese von Derivaten des 3-Oxepins und des Furans durch eine zweifache Wittig-Reaktion. In: Chem. Ber. Band 99, Nr. 2, 1966, S. 634–641, doi:10.1002/cber.19660990238.
- ↑ a b A. Rosowsky: The Chemistry of Heterocyclic Compounds, Seven-Membered Heterocyclic Compounds Containing Oxygen and Sulfur, 26th Volume, II. Oxepin Ring Systems Containing Two Rings. Wiley-Interscience, New York 1972, ISBN 0-471-38210-8, S. 96.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. Liu, A. Steigel, E. Reininger, R. Bauer: Two New Prenylated 3-Benzoxepin Derivatives as Cyclooxygenase Inhibitors from Perilla frutescens var. acuta. In: J. Nat. Prod. Band 63, Nr. 3, 2000, S. 403–405, doi:10.1021/np990362o.
- ↑ A. Ulubelen, E. Tuzlaci, N. Atilan: Oxepine derivatives and anthraquinones from Asphodeline tenuior and A. Taurica. In: Phytochem. Band 28, Nr. 2, 1989, S. 649–650, doi:10.1016/0031-9422(89)80076-7.
- ↑ J.C. Bill, D.S. Tarbell: o-Phthalaldehyde In: Organic Syntheses. 34, 1954, S. 82, doi:10.15227/orgsyn.034.0082; Coll. Vol. 4, 1963, S. 807 (PDF).
- ↑ Patent US20040242799A1: Process to bromomethylate aromatic compounds. Angemeldet am 29. August 2001, veröffentlicht am 2. Dezember 2004, Erfinder: M. Grabarnick, Y. Sasson.
- ↑ a b G.R. Ziegler: Mechanisms of photochemical reactions in solution. LVII. Photorearrangement of 1,4-epoxy-1,4-dihydronaphthalene to benz[f]oxepin. In: J. Am. Chem. Soc. Band 91, Nr. 2, 1969, S. 446–449, doi:10.1021/ja01030a040.
- ↑ A.M. Jeffrey, D.M. Jerina: Autoxidation of 1,4-dihydronaphthalene. Formation of 3-benzoxepin via pyrolysis of 2-hydroperoxy-1,2-dihydronaphthalene. In: J. Am. Chem. Soc. Band 94, Nr. 11, 1972, S. 4048–4049, doi:10.1021/ja00766a084.