3-Methyl-1,2-butadien
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
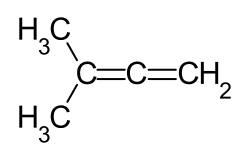
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3-Methyl-1,2-butadien | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 68,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,694 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
40–41 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Diethylether, Benzol, Aceton und Ethanol[2] | |||||||||||||||
| Brechungsindex |
1,419 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
3-Methyl-1,2-butadien ist eine chemische Verbindung aus der Gruppe der Allene.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]3-Methyl-1,2-butadien kann durch Reaktion von 1,1-Dichlor-2-ethoxy-3,3-dimethylcyclopropan mit Methyllithium und Diethylether gewonnen werden.[3][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Methyl-1,2-butadien ist eine farblose Flüssigkeit, die löslich in Diethylether, Benzol, Aceton und Ethanol ist.[2]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Unter Einwirkung von Licht und in Gegenwart von Methanol reagiert 3-Methyl-1,2-butadien mit aromatischen Nitrilen wie 1,2,4,5-Tetracyanobenzol (CAS-Nummer: 712-74-3), 1,4-Dicyanobenzol oder 1,4-Dicyanonaphthalin (CAS-Nummer: 3029-30-9). Durch das Licht wird zunächst ein Nitrilmolekül angeregt. Dieses reagiert mit dem Allen, wobei es selbst ein Radikalanion und das Allen ein Radikalkation bildet. Dann wird zunächst Methanol unter Verlust eines Protons an die Doppelbindung addiert, anschließend das Nitril-Radikalanion unter Verlust eines Cyanid-Ions.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Datenblatt 3-Methyl-1,2-butadiene, 97% bei Sigma-Aldrich, abgerufen am 12. August 2019 (PDF).
- ↑ a b Datenblatt 3-Methyl-1,2-butadiene, 97+% bei Alfa Aesar, abgerufen am 12. August 2019 (Seite nicht mehr abrufbar).
- ↑ Lars Skattebøl: Chemistry of gem-Dihalocyclopropanes. IV. Ring Opening of gem-Dichlorocyclopropyl Ethers. In: The Journal of Organic Chemistry. 31, 1966, S. 1554–1559, doi:10.1021/jo01343a057.
- ↑ PrepChem.com: Synthesis of 3-methylbuta-1,2-diene - PrepChem.com, accessdate: 12. August 2019.
- ↑ Dino Mangion, Donald R. Arnold, T. Stanley Cameron, Katherine N. Robertson: The electron transfer photochemistry of allenes with cyanoarenes. Photochemical nucleophile–olefin combination, aromatic substitution (photo-NOCAS) and related reactions. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 1, 2001, S. 48–60, doi:10.1039/b007205m.


