4-Hydroxy-1,3-thiazole

Die 4-Hydroxy-1,3-thiazole sind chemische Verbindungen, welche zu der Gruppe der substituierten fünfgliedrigen Heterozyklen gehören. Nach CAS-Nomenklatur führt der Stammheterozyklus Thiazol ein Schwefelatom in der 1. Position und ein Stickstoffatom in der 3. Position. Die 4-Hydroxythiazole verfügen über eine Hydroxygruppe, welche sich im tautomeren Gleichgewicht mit dem Ketokörper befindet. Hydroxyderivate, also aromatische Verbindungen, zeichnen sich oft durch Fluoreszenz im Festkörper und in Lösung aus.[1] Sie erfahren in den letzten Jahren einen breiten Einsatz in unterschiedlichen Applikationsfeldern der Wissenschaft.
Darstellung
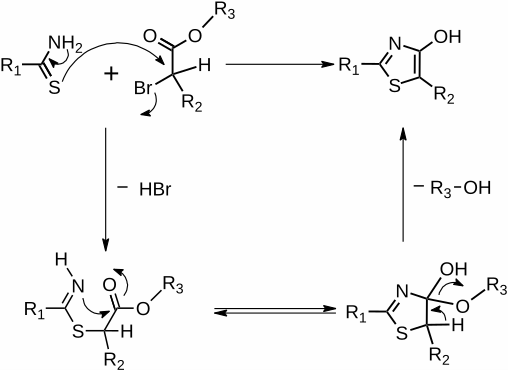
[Bearbeiten | Quelltext bearbeiten]Zur Darstellung der 4-Hydroxy-1,3-thiazole können grundlegend zwei Synthesevarianten herangezogen werden. Die Synthese nach Erlenmeyer, unter dem Einsatz von α-Mercaptocarbonylverbindungen und aromatischen Carbonitrilen als Edukte sowie die Synthese nach Hantzsch, ausgehend von Thioamiden und α-Halogencarbonylderivaten. Da nur wenige Mercaptocarbonylderivate kommerziell verfügbar sind und als olfaktorisch belastend empfunden werden, wird bevorzugt auf die Hantzsche Thiazolsynthese zurückgegriffen. Im Gegensatz zur Erlenmeyersynthese, bei der schon katalytische Mengen an Base ausreichen, benötigt die Synthese nach Hantzsch, äquimolare Mengen an geeigneter Base. Zumeist werden dafür Triethylamin (TEA) oder Pyridin verwendet. Die Synthese verläuft bei moderaten Bedingungen und liefert gute Ausbeuten.[2]

Der mechanistische Ablauf dieser Reaktion, welche auch als Tandemreaktion[3] bezeichnet wird, umfasst im ersten Schritt einen nucleophilen Angriff des Schwefels auf die α-Position der Carbonylverbindung. Im Zuge dieser Substitutionsreaktion kommt es zur Bildung von Bromwasserstoff, welcher durch zugefügte Base abgefangen wird. Im zweiten Schritt bildet sich ein Zwischenprodukt aus, welches anschließend in einer Kondensationsreaktion zu einem Ring geschlossen wird.[4]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die 2,5-substituierten 4-Hydroxy-1,3-thiazole sind in der Regel in organischen Lösungsmitteln gut und in Wasser nicht löslich, wobei die Löslichkeit in Abhängigkeit von den Substituenten in der 2. und 5. Position variiert. Ebenso, wird die Fluoreszenz der 4-Hydroxythiazole durch die vorhandenen funktionellen Gruppen beeinflusst.[2] So lässt sich bei dieser Farbstoffklasse eine, in weiten Grenzen, einstellbare Fluoreszenz erreichen. Zusätzlich können solvatochrome Effekte, also Farbänderungen in Abhängigkeit des verwendeten Lösungsmittel beobachtet werden. Ebenso treten Änderungen von Absorption und Emission bei Änderung des pH-Wertes auf. 2-Pyridyl-Substituenten können dabei zum Beispiel durch Protonierung Einfluss nehmen. pH-Werte und solvatochrome Effekte, können oft schon visuell verfolgt werden.
Gelöst in DMSO können, je nach Substitutionsmuster, bei Zugabe von Natronlauge Farbumschläge nach rot über violett bis blau realisiert werden. In protischen Lösungsmitteln z. B. im Methanol, wird die Lösung nach der Deprotonierung zumeist rot.
Außerdem weisen die Vertreter der 2,5-substituierten 4-Hydroxythiazole auffällig große Stokes-Verschiebung. Diese liegen bei manchen Molekülen zwischen 4700 und 6600 cm−1. Durch den weiten Abstand der Anregungs- und Emissionsmaxima können technische Probleme, welche durch mögliche Interferenz der Signale zustande kommen, reduziert werden und den aufwendigen Einsatz von speziellen Filtern zur Bereinigung der Emission unnötig machen.[5]
Die 4-Hydroxythiazole liegen fast ausschließlich als Feststoffe vor und weisen, je nach Substitution, unterschiedliche Schmelzpunkte auf. Sie lassen sich im Vakuum sublimieren.[2]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die vorliegende OH-Gruppe verleiht den 4-Hydroxythiazolen einen schwach sauren, quasi phenolischen Charakter und lässt sich durch Einwirkung von Base leicht deprotonieren. Auf diese Weise erzeugte Anionen sind im Verhalten den Phenolationen ähnlich und weisen in ihrer Fluoreszenz eine Verschiebung zu höheren Wellenlängen. Neben der Deprotonierung ist auch die Veretherung der Hydroxygruppe leicht zu realisieren, wobei diese Modifikation ebenfalls eine signifikante Auswirkung auf die spektroskopischen Eigenschaften der Moleküle zeigt. Eine weitere Besonderheit, welche die OH-Funktionalität der 4-Hydroxythiazole mit sich führt, ist die Möglichkeit einer Keto-Enol-Tautomerie. Außerdem findet man auch Berichte über sogenannte mesoionische Form dieser Moleküle.[6] In Betracht dessen, darf die Bedeutung des Substituenten in der fünften Position des Stammheterozyklus nicht unterschätzt werden. Denn gerade die Abwesenheit eines Substituenten in dieser Position, stellt des Öfteren eine Ursache für leichte Selbstkondensation bzw. Dimerisierung der Thiazolringe dar.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Speziell 4-Hydroxythiazolderivate erfahren mitunter technischen Einsatz. Aufgrund ihrer fluoreszenten Eigenschaften, wurden diese Moleküle zum einen erfolgreich für FRET-Applikationen in Terpyridinpolymeren mit Ru(II)-Komplex als Akzeptoreinheit integriert[8], zum anderen als Chromophore in sogenannten dye-sensitized solar cells (DSSC), auch als Grätzel-Zelle bekannt, verwendet.[9] Außerdem, ist die Anwendung der 4-hydroxythiazolbasierten Silyletherderivate als sensitive und selektive Ionendetektionssysteme beschrieben.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Homepage von Dieter Weiß. Abgerufen am 10. Dezember 2020.
- ↑ a b c E. Täuscher: Beiträge zur Chemie der 4-Hydroxy-1,3-Thiazole. FSU Jena, Dissertation 2012.
- ↑ W. Walter, W. Francke: Lehrbuch der organische Chemie. Hrsg.: H. Bayer. 23. Auflage. S. Hirzel Verlag, Stuttgart/Leipzig 1998, ISBN 3-7776-0808-4, S. 802.
- ↑ D. T. Davies: Aromatic Heterocyclic Chemistry. In: Oxford Chemistry Primer. Nr. 2. Oxford University Press Inc., Oxford/New York/Tokyo 1992, ISBN 0-19-855660-8, S. 23–24 (englisch).
- ↑ S. Habenicht: Entwicklung 4-Hydroxythiazol-basierter Fluorophore für biochemische Applikationen. FSU Jena, Dissertation. Jena 2015.
- ↑ G. C. Barrett: The Chemistry of 1,3-Thiazolinone vs. Hydroxy1,3-thiazole Systems. In: Tetrahedron. Vol. 36, Nr. 88, 1980, S. 2025–2058 (englisch).
- ↑ H. Behringer, D. Weber: Monoacetylierte Dimere des 2-Phenyl-4-Hydroxy-Thiazols. In: Liebigs Ann. Chem. Band 682, 1965, S. 201–205.
- ↑ Bobby Happ, Johann Schäfer, Roberto Menzel, Martin D. Hager, Andreas Winter: Synthesis and Resonance Energy Transfer Study on a Random Terpolymer Containing a 2-(Pyridine-2-yl)thiazole Donor-Type Ligand and a Luminescent [Ru(bpy) 2 (2-(triazol-4-yl)pyridine)] 2+ Chromophore. In: Macromolecules. Band 44, Nr. 16, 23. August 2011, S. 6277–6287, doi:10.1021/ma201193e (englisch).
- ↑ Roberto Menzel, Daniel Ogermann, Stephan Kupfer, Dieter Weiß, Helmar Görls: 4-Methoxy-1,3-thiazole based donor-acceptor dyes: Characterization, X-ray structure, DFT calculations and test as sensitizers for DSSC. In: Dyes and Pigments. Band 94, Nr. 3, September 2012, S. 512–524, doi:10.1016/j.dyepig.2012.02.014 (englisch).
- ↑ Lorena K. Calderón-Ortiz, Eric Täuscher, Erick Leite Bastos, Helmar Görls, Dieter Weiß: Hydroxythiazole-Based Fluorescent Probes for Fluoride Ion Detection. In: European Journal of Organic Chemistry. Band 2012, Nr. 13, Mai 2012, S. 2535–2541, doi:10.1002/ejoc.201200140 (englisch).