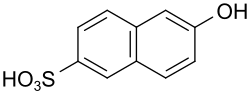
6-Hydroxynaphthalin-2-sulfonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6-Hydroxynaphthalin-2-sulfonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H8O4S | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Natriumsalz)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 224,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
6-Hydroxynaphthalin-2-sulfonsäure (Trivialname Schäffer-Säure) ist eine chemische Verbindung aus der Gruppe der Buchstabensäuren.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]6-Hydroxynaphthalin-2-sulfonsäure kann durch Sulfonierung von 2-Naphthol mit Schwefelsäure, gegebenenfalls unter Zusatz von Natriumsulfat, gewonnen werden. Zunächst erfolgt die Sulfonierung in der 1-Position zur 2-Hydroxynaphthalin-1-sulfonsäure, gefolgt von der Sulfonierung in der 6-Position. Die 2-Hydroxynaphthalin-1,6-disulfonsäure wird anschließend zum Endprodukt desulfoniert.[3][4][5] Die Darstellung der 6-Hydroxynaphthalin-2-sulfonsäure wurde 1869 von Louis Schaeffer beschrieben. Nach der Umsetzung von 2-Naphthol mit Schwefelsäure isolierte er das Produkt durch Neutralisation mit Bleicarbonat als Bleisalz. Aus der wässrigen Lösung des Bleisalzes kann die freie Säure durch Umsetzung mit Schwefelwasserstoff erhalten werden.[6][7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]6-Hydroxynaphthalin-2-sulfonsäure ist ein weißer Feststoff, der sehr gut löslich in Wasser ist.[1][2] Das aus wässrigen Lösungen auskristallisierenden Dihydrat schmilzt ohne Zersetzung bei 118 °C. Das Anhydrat schmilzt ohne Zersetzung bei 167 °C. Der meist angegebene Schmelzpunkt von 125 °C passt zu dem gewöhnlich bei den normalen Herstellungs- und Trocknungsverfahren entstehenden Monohydrat.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Das (auch Schäffers-Salz genannte) Natriumsalz der 6-Hydroxy-2-naphthalinsulfonsäure ist eine Kupplungskomponente, die zur Herstellung von Azofarbstoffen verwendet wird.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu 6-Hydroxy-2-naphthalenesulfonic Acid Sodium Salt bei Toronto Research Chemicals, abgerufen am 20. Januar 2023 (PDF).
- ↑ a b c d e David R. Lide: CRC Handbook of Chemistry and Physics. (Special Student Edition). CRC-Press, 1995, ISBN 978-0-8493-0595-5, S. 673 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Reinhard Brückner: Reaktionsmechanismen Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. Springer-Verlag, 2014, ISBN 978-3-662-45684-2, S. 210 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Industrielle Aromatenchemie Rohstoffe · Verfahren · Produkte. Springer-Verlag, 2013, ISBN 978-3-662-07875-4, S. 330 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Vaishali M. Umrigar, Mousumi Chakraborty, Parimal A. Parikh: Microwave Assisted Sulfonation of 2-Naphthol by Sulfuric Acid: Cleaner Production of Schaeffer's Acid. In: Industrial & Engineering Chemistry Research. Band 46, Nr. 19, 2007, S. 6217–6220, doi:10.1021/ie0705352.
- ↑ a b Karl H. Engel, A. Witt Hutchison: Electrometric Studies on the 2-hydroxynaphthalene Sulfonic Acids. Preparation of Pure 2-hydroxynaphthalene-6-sulfonic Acid. In: Journal of the American Chemical Society. Band 52, Nr. 1, 1930, S. 211–217, doi:10.1021/ja01364a030.
- ↑ L. Schaeffer: III. Ueber isomere Naphtole und einige Derivate derselben. In: Annalen der Chemie und Pharmacie. Band 152, Nr. 3, 1869, S. 279–298, doi:10.1002/jlac.18691520304.
