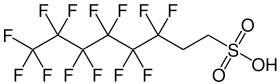
6:2-Fluortelomersulfonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6:2-Fluortelomersulfonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H5F13O3S | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis hellbrauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 428,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,953 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
87 °C[1] | ||||||||||||||||||
| pKS-Wert |
1,31[2] | ||||||||||||||||||
| Löslichkeit |
658 g·l−1 in Wasser (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
6:2-Fluortelomersulfonsäure (6:2-FTS) ist eine chemische Verbindung, die zur Gruppe der Fluortelomersulfonsäuren innerhalb der per- und polyfluorierten Alkylverbindungen (PFAS) gehört. Aufgrund ihrer strukturellen Ähnlichkeit zu PFOS wird sie auch H4PFOS genannt.[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]6:2-FTS wird mittels Telomerisation hergestellt. Zudem entsteht sie beispielsweise auch aus einigen Perfluorcarboxybetainen nach deren Spaltung.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Der Octanol-Wasser-Verteilungskoeffizient (log KOW) liegt bei 3,47–3,98.[4]
Der BSAF für Regenwürmer liegt bei 3,06 (Durchschnittswert aus Labor- und Felddaten).[5]
Durch biologischen Abbau wird 6:2-FTS primär in die Perfluorcarbonsäuren Perfluorhexansäure, Perfluorpentansäure und Perfluorbutansäure umgewandelt.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]6:2-FTS sowie deren Derivate werden als Ersatzprodukt für Perfluoroctansulfonsäure (PFOS) bzw. deren Salze in Löschschäumen verwendet.[2][7] Es wird auch bei Hart- und Dekorativverchromungsverfahren in der Galvanotechnik als Ersatz für das verbotene PFOS eingesetzt.[8][9][10] Unter REACH war 6:2-FTS vorerst nur vorregistriert, wurde dann aber 2019 für den Tonnagebereich von 1–10 Jahrestonnen im EWR registriert.[11]
Laut Angaben der chemischen Industrie handelt es sich bei der 6:2-Fluortelomersulfonsäure um eine von 256 PFAS mit kommerzieller Relevanz[12][13] aus der OECD-Liste von 4730 PFAS.[14]
Toxizität
[Bearbeiten | Quelltext bearbeiten]Der EC50 bei Eisenia fetida liegt bei 253 mg/kg (Reproduktionstest).[4]
Literatur
[Bearbeiten | Quelltext bearbeiten]- N. Wang, J. Liu, R. C. Buck, S. H. Korzeniowski, B. W. Wolstenholme, P. W. Folsom, L. M. Sulecki: 6:2 fluorotelomer sulfonate aerobic biotransformation in activated sludge of waste water treatment plants. In: Chemosphere. Band 82, Nummer 6, Februar 2011, S. 853–858, doi:10.1016/j.chemosphere.2010.11.003, PMID 21112609.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu 3,3,4,4,5,5,6,6,7,7,8,8,8-Tridecafluoroctansulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c laenderfinanzierungsprogramm.de: 01_Anhang_A_Grundlagen PFC-Arbeitshilfe ( vom 23. September 2016 im Internet Archive), abgerufen am 23. September 2016.
- ↑ PFT und Analytik ( vom 22. September 2016 im Internet Archive). LANUV, abgerufen am 23. September 2016.
- ↑ a b The Danish Environmental Protection Agency: Short chain Polyfluoroalkyl Substances (PFAS), 2015, ISBN 978-87-93352-15-5, abgerufen am 23. September 2016.
- ↑ Lawrence P. Burkhard, Lauren K. Votava: Review of per- and polyfluoroalkyl substances (PFAS) bioaccumulation in earthworms. In: Environmental Advances. Band 11, April 2023, S. 100335, doi:10.1016/j.envadv.2022.100335 (englisch).
- ↑ Felix Grimberg, Thomas M. Holsen, Sujan Fernando, Siwen Wang: Biotransformation of 6:2 fluorotelomer sulfonate (6:2 FTS) in sulfur-rich media by Trametopsis cervina. In: Frontiers of Environmental Science & Engineering. Band 18, Nr. 9, 2024, S. 107, doi:10.1007/s11783-024-1867-5.
- ↑ The use of PFAS and fluorine-free alternatives in fire-fighting foams. 2020 (europa.eu [PDF; 3,9 MB]).
- ↑ Xiaoling Yang, Jun Huang, Kunlun Zhang, Gang Yu, Shubo Deng, Bin Wang: Stability of 6:2 fluorotelomer sulfonate in advanced oxidation processes: degradation kinetics and pathway. In: Environmental Science and Pollution Research. 21, 2014, S. 4634–4642, doi:10.1007/s11356-013-2389-z.
- ↑ H. Hauser, L. Füglister, T. Scheffelmaier: Verwendung von Fluortensiden in der Galvanikbranche, 2020.
- ↑ Wolfram Willand, Yifaat Baron, Markus Blepp, Roland Weber, Christine Herold: Beste verfügbare Techniken für die PFOS-Substitution in der Oberflächenbehandlung von Metallen und Kunststoffen sowie Analyse der alternativen Substanzen zu PFOS beim Einsatz in Anlagen zur Verchromung und Kunststoffbeize. Umweltbundesamt, November 2020 (umweltbundesamt.de).
- ↑ InfoCard zu 3,3,4,4,5,5,6,6,7,7,8,8,8-tridecafluorooctanesulphonic acid der Europäischen Chemikalienagentur (ECHA), abgerufen am 18. November 2019.
- ↑ Robert C. Buck, Stephen H. Korzeniowski, Evan Laganis, Frank Adamsky: Identification and Classification of Commercially Relevant Per- and Poly-fluoroalkyl Substances (PFAS). In: Integrated Environmental Assessment and Management. doi:10.1002/ieam.4450.
- ↑ There’s no need to control PFAS as a class, industry scientists say. In: Chemical & Engineering News. 19. Mai 2021, abgerufen am 10. April 2022.
- ↑ Toward a New Comprehensive Global Database of Per- and Polyfluoroalkyl Substances (PFASs): Summary Report on Updating the OECD 2007 List of Per- and Polyfluoroalkyl Substances (PFASs) (= OECD Series on Risk Management of Chemicals. Nr. 39). OECD, 2018, ISBN 978-92-64-88443-4, doi:10.1787/1a14ad6c-en.


