Actinidain
Zur Navigation springen
Zur Suche springen
| Actinidain (Actinidia chinensis) | ||
|---|---|---|
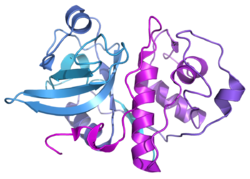
| ||
| Bändermodell des Enzyms aus Actinidia chinensis, nach PDB 1AEC | ||
| Masse/Länge Primärstruktur | 254 Aminosäuren | |
| Präkursor | (380 aa) | |
| Bezeichner | ||
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.22.14, Cysteinprotease | |
| MEROPS | C01.007 | |
| Reaktionsart | Peptidspaltung | |
| Substrat | Protein | |
| Produkte | kleinere Proteine | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
Actinidain (fälschlicherweise auch als Actinidin[2] bezeichnet, siehe Actinidin) ist ein Enzym in der Kiwifrucht, das den Abbau von Proteinen katalysiert. Es ruft bei einigen Personen eine allergische Reaktion hervor und wurde als Haupt-Allergen in Kiwis identifiziert. Technisch eignet sich Actinidain hervorragend zum Abbau von Collagen und Trennung von Zelltypen in Fleisch-Mischgewebe.[3][4]
Da Actinidain im aktiven Zentrum Cystein enthält, handelt es sich um eine Cysteinprotease. Nahe Verwandte des Enzyms kommen in allen Strahlengriffel-Früchten und in den Früchten des Zedrachbaumes vor. Weitere Verwandte sind in Ananas, Mango und Papaya zu finden (Papain).[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Interpro-Eintrag.
- ↑ Christiane Högermann: Enzymdenaturierung mit Kiwis. In: Biologie in unserer Zeit. 2015, Band 45, Nummer 4, S. 217–218 doi:10.1002/biuz.201590060.
- ↑ E. Pastorello et al.: Identification of actinidin as the major allergen of kiwi fruit, Journal of Allergy and Clinical Immunology, 101(4), S. 531–537, PMID 9564807.
- ↑ Mostafaie et al.: Kiwifruit actinidin: a proper new collagenase for isolation of cells from different tissues. Appl. Biochem. Biotechnol. 144, 123–131 (2008), PMID 18456944.
- ↑ MEROPS-Eintrag Familie C01A.