Actinium(III)-fluorid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
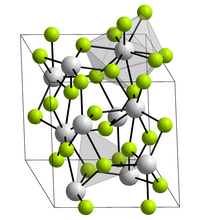
| |||||||
| _ Ac3+ _ F− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
P3c1 (Nr. 165) | ||||||
| Gitterparameter |
a = 741 pm | ||||||
| Koordinationszahlen |
Ac[9], F[3] | ||||||
| Allgemeines | |||||||
| Name | Actinium(III)-fluorid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | AcF3 | ||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 284,02 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte | |||||||
| Gefahren- und Sicherheitshinweise | |||||||
 Radioaktiv | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Actinium(III)-fluorid ist eine chemische Verbindung der Elemente Actinium und Fluor.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Actinium(III)-fluorid kann entweder in Lösung oder durch Feststoffreaktion dargestellt werden. Im ersten Fall gibt man bei Raumtemperatur Flusssäure zu einer Ac3+-Lösung und fällt das Produkt aus.
Im anderen Fall wird Actinium-Metall mit Fluorwasserstoff bei 700 °C in einer Platinapparatur behandelt.[3][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Actinium(III)-fluorid ist ein weißer Feststoff. Es kristallisiert trigonal in der Raumgruppe P3c1 (Raumgruppen-Nr. 165) mit den Gitterparametern a = 7,41 Å und c = 7,55 Å sowie sechs Formeleinheiten pro Elementarzelle.[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Umsetzung von Actinium(III)-fluorid mit feuchtem Ammoniak bei 900–1000 °C liefert das Actiniumoxidfluorid AcOF.
Während Lanthanoxifluorid leicht durch das Erhitzen von Lanthan(III)-fluorid in Luft bei 800 °C in etwa einer Stunde entsteht, ergibt eine ähnliche Behandlung von Actinium(III)-fluorid kein AcOF und führt nur zu einer Schmelze der ursprünglichen Substanz.[3][4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b W. H. Zachariasen: Crystal Chemical Studies of the 5f-Series of Elements. XII. New Compounds Representing known Structure Types. In: Acta Crystallographica. 2, 1949, S. 388–390, doi:10.1107/S0365110X49001016.
- ↑ Gerd Meyer, Lester R. Morss: Synthesis of lanthanide and actinide compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Sherman Fried, French Hagemann, W. H. Zachariasen: The Preparation and Identification of Some Pure Actinium Compounds. In: J. Am. Chem. Soc. 72, 1950, S. 771–775, doi:10.1021/ja01158a034.
- ↑ a b c Gerd Meyer, Lester R. Morss: Synthesis of lanthanide and actinide compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 87–88 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.

