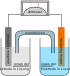
Aluminium-Luft-Batterie
Die Aluminium-Luft-Batterie ist eine elektrisch nicht wiederaufladbare Primärzelle, deren Spannung pro Zelle 1,2 V beträgt und durch eine chemische Reaktion von Luftsauerstoff mit Aluminium entsteht. Die Aluminium-Luft-Batterie weist eine hohe Energiedichte von 1300 Wh/kg auf.[1] Aufgrund der vergleichsweise hohen Betriebskosten hat die Aluminium-Luft-Batterie allerdings gegenüber anderen elektrischen Speichersystemen nur eine geringe Verbreitung. Anwendungen gibt es im militärischen Bereich für den Antrieb elektrisch betriebener Fahrzeuge. Elektrofahrzeuge mit Aluminium-Luft-Batterie als Energiespeicher erzielen, bei sonst identischen Bedingungen und gleichem Gewicht, im Vergleich zu Lithium-Ionen-Akkumulatoren eine ca. 8-fache Reichweite.[2]
Nachteile
[Bearbeiten | Quelltext bearbeiten]Da die Aluminium-Luft-Batterie elektrisch nicht aufladbar ist, muss bei Wiederverwendung die verbrauchte Anode aus Aluminium und der Elektrolyt physisch ersetzt werden. Außerdem weist die Batterie eine hohe Selbstentladung auf, weshalb in manchen Anwendungen der Elektrolyt erst kurz vor oder während des Betriebs in die Zelle eingesetzt wird. Die dafür notwendigen zusätzlichen technischen Einrichtungen sind der primäre Grund für die vergleichsweise geringe Verbreitung und die hohen Betriebskosten.[1]
Reaktionsgleichungen
[Bearbeiten | Quelltext bearbeiten]Die an der Anode aus Aluminium ablaufende Oxidation bei der Entladung ist:
An der aus Kohlenstoff bestehenden Kathode läuft folgende Reduktion ab:
Die Redoxreaktion lautet:
Die Klemmenspannung mit 1,2 V wird bei Verwendung von Kaliumhydroxid als Elektrolyt erzielt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Shaohua Yang, Harold Knickle: Design and analysis of aluminum/air battery system for electric vehicles. In: Journal of Power Sources. Band 112, Nr. 1, 2002, S. 162–173, doi:10.1016/S0378-7753(02)00370-1.
- ↑ N. Fitzpatrick, F. Smith, P. Jeffrey: The Aluminum-Air Battery. In: SAE Technical Paper 830290. 1983, doi:10.4271/830290.