Americium(III)-fluorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Am3+ _ F− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P63/mmc (Nr. 194) | |||||||||
| Gitterparameter |
a = 704,4 pm | |||||||||
| Koordinationszahlen |
Am[9], F[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Americium(III)-fluorid | |||||||||
| Andere Namen |
Americiumtrifluorid | |||||||||
| Verhältnisformel | AmF3 | |||||||||
| Kurzbeschreibung |
rosafarbene hexagonale Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 300,06 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
9,53 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Americium(III)-fluorid ist ein Fluorid des künstlichen Elements und Actinoids Americium mit der Summenformel AmF3. In diesem Salz tritt Americium in der Oxidationsstufe +3 auf.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Americium(III)-fluorid kann durch die Umsetzung einer wässrigen Americiumlösung mit Fluoridsalzen im schwach Sauren hergestellt werden.
Im wasserfreien Zustand kann es ansonsten auch aus Americium(III)-hydroxid bei 600–750 °C in einem 1:1 Gasgemisch von HF/O2 hergestellt werden:[5]
Eigenschaften
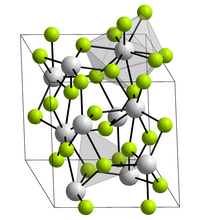
[Bearbeiten | Quelltext bearbeiten]Americium(III)-fluorid ist ein rosafarbener Feststoff, der bei 1393 °C schmilzt.[3] Es kristallisiert in der Lanthanfluoridstruktur mit den Gitterparametern a = 704,4 pm und c = 722,5 pm.[6] Hierbei ist jeder Americiumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Metallisches Americium kann durch Reduktion aus Americium(III)-fluorid erhalten werden. Dieses wird hierzu in wasser- und sauerstofffreier Umgebung in Reaktionsapparaturen aus Tantal und Wolfram mit elementarem Barium zur Reaktion gebracht.[7][8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b L. B. Asprey, T. K. Keenan, F. H. Kruse: Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium, in: Inorg. Chem., 1965, 4 (7), S. 985–986 (doi:10.1021/ic50029a013).
- ↑ Americium(III)-fluorid bei www.webelements.com.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Sherman Fried: The Preparation of Anhydrous Americium Compounds, in: J. Am. Chem. Soc., 1951, 73 (1), S. 416–418 (doi:10.1021/ja01145a135).
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 102.
- ↑ Edgar F. Westrum, Jr., LeRoy Eyring: The Preparation and Some Properties of Americium Metal, in: J. Am. Chem. Soc., 1951, 73 (7), S. 3396–3398 (doi:10.1021/ja01151a116).
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil B 1, S. 57–67.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Wolfgang H. Runde, Wallace W. Schulz: Americium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1265–1395 (doi:10.1007/1-4020-3598-5_8).


