Fluoride
Fluoride sind die Salze der Fluorwasserstoffsäure (HF), die auch als Flusssäure bekannt ist. Fluoride im engsten Sinne enthalten in Lösung oder in ihrem Ionengitter als negative Gitterbausteine (Anionen) Fluorid-Ionen (F−). Im weitesten Sinne können alle Fluorverbindungen als Fluoride bezeichnet werden, darunter auch kovalente, nicht-ionische Verbindungen von Nichtmetallen sowie organische Fluorverbindungen. Im Falle der Fluorkohlenwasserstoffe und der Fluorchlorkohlenwasserstoffe ist die Benennung als Fluorid, z. B. Alkylfluorid, nicht mehr die bevorzugte Variante, während bei Carbonsäurederivaten wie Acetylfluorid die Bezeichnung als Fluorid üblich ist.
Einleitung
[Bearbeiten | Quelltext bearbeiten]
Als Beispiel für ein typisches Fluorid sei hier das Natriumfluorid NaF genannt, ein weißer, hochschmelzender Feststoff (Schmelzpunkt 993 °C). Im festen NaF wechseln sich Na+- und F−-Ionen auf den Gitterplätzen ab, so dass die Ionen die Natriumchlorid-Struktur bilden. In Lösung liegen frei bewegliche Na+- und F−-Ionen vor, wobei jedes Ion von einer lose gebundenen Hydrathülle umgeben ist.
Natürliches Vorkommen
[Bearbeiten | Quelltext bearbeiten]

Fluoride kommen in Form vieler Mineralien in der Natur und im menschlichen Körper vor. Wichtigster Vertreter ist der Fluorit (CaF2), ferner Yttrofluorit, ein Additions-Mischkristall mit YF3, und Cerfluorit (auch Yttrocerit), der neben Yttrium noch Cer, Erbium und Hydratwasser enthält. Weitere Fluoride sind Frankdicksonit (BaF2), Gagarinit (NaCaYF6), Tysonit (auch Fluocerit, (Ce,La,Se)F3) und Neighborit (NaMgF3). Komplexe Fluoride enthalten ein weiteres Element innerhalb eines Anion-Komplexes, wie etwa Bor, Aluminium oder Silicium, und bilden dann z. B. Hexafluorosilikate oder Tetrafluorborate. Vertreter sind hier das Ferruccit (NaBF4), Avogadrit ((K,Cs)BF4), Malladrit (Na2SiF6), Hieratit (K2SiF6), Kryolithionit (Na3Al2Li3F12), Kryolith (Na3AlF6), Elpasolith (K2Na[AlF6]), Jarlit (NaSr2[AlF6]2), Usovit (Ba2Mg[AlF6]2) und Weberit (Na2MgAlF7).[1]
Übersicht über binäre Fluoride
[Bearbeiten | Quelltext bearbeiten]Abgesehen von den leichteren Edelgasen und natürlich abgesehen von Fluor selbst können alle Elemente Fluoride bilden. Binäre Fluoride enthalten nur ein weiteres Element.
Fluoride der Hauptgruppenelemente
[Bearbeiten | Quelltext bearbeiten]Die Tabelle gibt eine Übersicht über die wichtigsten binären Fluoride der Hauptgruppenelemente. Außer den Kohlenstoffverbindungen (Perfluorcarbone wie beispielsweise Tetrafluormethan, Difluoracetylen oder Tetrafluorethen) sind sämtliche binären Fluoride anorganische Verbindungen.
a) Stickstoff bildet auch Stickstoff(II)-fluorid (Distickstofftetrafluorid F2N–NF2) und Stickstoff(I)-fluorid F–N=N–F
b) Chlor bildet außer Chlorfluorid ClF auch Chlortrifluorid ClF3 und Chlorpentafluorid ClF5
c) Gallium(I)-fluorid GaF ist nur bei hohen Temperaturen beständig
d) Brom bildet außer Bromfluorid BrF auch Bromtrifluorid BrF3 und Brompentafluorid BrF5
e) Kryptondifluorid KrF2 ist instabil und zersetzt sich.
f) Iod: Iodfluorid IF ist nur unterhalb −14 °C stabil, Iodtrifluorid IF3 ist nur unterhalb −28 °C beständig
Fluoride der Nebengruppenelemente
[Bearbeiten | Quelltext bearbeiten]Beispiele für Fluoride der Nebengruppenelemente sind Titan(III)-fluorid TiF3 und Titan(IV)-fluorid TiF4, Osmium(VI)-fluorid, Platin(VI)-fluorid oder Zinkfluorid. Auch manche Actinoide bilden Hexafluoride: Uran(VI)-fluorid, Neptunium(VI)-fluorid oder Plutonium(VI)-fluorid.
Bindungsverhältnisse
[Bearbeiten | Quelltext bearbeiten]Alkalimetallfluoride und Erdalkalifluoride gelten als salzartige Stoffe mit vorwiegend ionischer Bindung. Geht man im Periodensystem von links nach rechts nimmt der kovalente Bindungscharakter zu (besonders schnell in der Reihe Lithiumfluorid mit Natriumchlorid-Struktur, Schmelzpunkt 845 °C, Berylliumfluorid mit Quarz-Struktur und Schmelzpunkt 555 °C zum Bortrifluorid, ein Gas (Schmelzpunkt −100,4 °C) aus BF3-Molekülen mit kovalenter B–F-Bindung). Auch mit zunehmender Oxidationszahl der Fluoride nimmt der kovalente Charakter der Bindungen zu. Das zeigt sich beispielsweise an den Hexafluoriden, von denen einige gasförmig sind (Wolframhexafluorid, Schwefelhexafluorid, Selenhexafluorid, Tellurhexafluorid), was ein Hinweis darauf ist, dass es sich um Molekül- und nicht um Ionenverbindungen handelt. Auch die sog. Sauerstofffluoride haben mit salzartigen Fluoriden nichts zu tun und auch nichts mit Oxiden, denn in ihnen hat der Sauerstoff keine negative, sondern eine positive Oxidationszahl.
Weitere anorganische Fluoride
[Bearbeiten | Quelltext bearbeiten]Ternäre Fluoride
[Bearbeiten | Quelltext bearbeiten]Zu den wichtigeren ternären Fluoriden gehören beispielsweise:
- Fluorid im engeren Sinne, mit isoliertem Fluoridion:
- Ammoniumfluorid NH4F
- Stabile Fluorokomplexionen enthalten kein isoliertes Fluoridion (kein F−) und sind daher keine Fluoride im engeren Sinne, lediglich im weitesten Sinne von Fluorverbindungen:
- einfache Tetrafluoroborate wie Lithiumtetrafluorborat LiBF4, Natriumtetrafluoroborat NaBF4 (auch als seltenes Mineral Ferruccit), Kaliumtetrafluoroborat KBF4 oder Silbertetrafluoroborat AgBF4
- Natriumhexafluoroaluminat Na3AlF6, das als Mineral Kryolith natürlich vorkommt
- Hexafluorosilicate, wie Lithiumhexafluorosilicat LiSiF6, Natriumhexafluorosilicat NaSiF6, Kaliumhexafluorosilicat KSiF6
- Kovalente Fluoride, in denen das Fluoratom per Elektronenpaarbindung gebunden ist:
- Nitrosylfluorid NOF (F–N=O)
- Phosphoroxidfluorid POF3 (O=PF3)
- Sulfurylfluorid SO2F2
- Peroxydisulfuryldifluorid F2O6S2 (F–SO2–O–O–SO2–F)
Hydrogendifluoride
[Bearbeiten | Quelltext bearbeiten]
Neben den einfachen Fluoriden existieren auch Hydrogendifluoride der Zusammensetzung Me+[HF2]−, wie etwa Natriumhydrogendifluorid (NaHF2) und Kaliumhydrogendifluorid (KHF2). Diese enthalten das lineare [FHF]−-Anion. Darstellung ist aus wässrigen Lösungen der Fluoride unter Anwesenheit eines Überschusses Fluorwasserstoff (HF) möglich. Beim Erhitzen spalten die Hydrogendifluoride den Fluorwasserstoff wieder ab.[1]
Darstellung:
Zersetzung durch Erhitzen:
Organische Fluoride
[Bearbeiten | Quelltext bearbeiten]
In den meisten organischen Fluoriden ist das Fluoratom kovalent gebunden. Fluorkohlenwasserstoffe und Fluorchlorkohlenwasserstoffe wurden früher als Fluoride benannt, beispielsweise leiteten sich von den Alkanen die Alkylfluoride ab. Heute bevorzugt die IUPAC die Benennung als Fluorverbindung, beispielsweise Fluoralkan statt Alkylfluorid. Dementsprechend lauten die bevorzugten Namen Tetrafluormethan (CF4) statt Kohlenstofftetrafluorid und Fluormethan (CH3F) statt Methylfluorid. Polyvinylfluorid oder Polyvinylidenfluorid sind Beispiele für Fluorkohlenwasserstoffe, bei denen sich die historischen Namen auf -fluorid erhalten haben.
Als organische Fluoride gelten Säurederivate wie:
- Carbonsäurefluoride, wie
- Acetylfluorid (CH3–CO–F)
- Benzoylfluorid (C6H5–CO–F)
- Fluoride organischer Phosphorsäuren, wie
- Sarin (C4H10FO2P)
Es gibt auch organische Verbindungen, in denen das Fluoratom salzartig als Fluorid-Anion (F−) enthalten ist und die daher eindeutig Fluoride im engeren Sinne sind. Beispiele:
- Hydrofluoride, darunter die besonders bedeutenden
- Aminfluoride, wie Olaflur
- Fluoride quartärer Ammoniumverbindungen, beispielsweise Tetrabutylammoniumfluorid Bu4N+ F−
Nachweis
[Bearbeiten | Quelltext bearbeiten]Physikalische Analyseverfahren
[Bearbeiten | Quelltext bearbeiten]Professionell werden heute Fluoride in Mineralien und Feststoffen mit Röntgenfluoreszenzanalyse, Röntgenbeugung oder Massenspektrometrie bestimmt, in Flüssigkeiten mit Fluorid-Elektroden, IR- oder NMR-Verfahren.
Nasschemisch
[Bearbeiten | Quelltext bearbeiten]
Mit einfachen Labormethoden lässt sich Fluorid durch den Bleitiegeltest oder die Ätzprobe nachweisen. Versetzt man eine fluoridhaltige Probe mit Schwefelsäure, so entsteht Fluorwasserstoff, der das Glasbehältnis anätzt.
Gibt man die Probe in einen Bleitiegel mit gepulverter Kieselsäure oder Natriumsilicat und überschichtet anschließend mit Schwefelsäure, so bildet sich Siliciumtetrafluorid-Gas:
Der Tiegel wird wieder verschlossen und die Abdeckung mit Wasser befeuchtet. Das Siliciumtetrafluorid reagiert mit dem Wasser wieder zu Silicat, das sich kraterförmig im Wassertropfen absetzt.[2]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]
Fluoride werden vor allem als Flussmittel in der Metallurgie, zur Synthese von organischen Fluorchemikalien sowie zur gasdichten Versiegelung von Kraftstoffbehältern verwendet; dabei werden die Kunststofftanks aus z. B. PA (Polyamid) mit dem gelösten Fluorid bedampft, dadurch diffundiert dieses ca. 3–4 Mikrometer in die Oberfläche ein.
Als Fluoridierung bezeichnet man die Zugabe von Fluoriden insbesondere zu Speisesalz, Trinkwasser, Milch, Tabletten und Zahnpasten zur Prophylaxe von Zahnkaries.
| F--Anteil [%] | Menge pro Anwendung [mg] | |
|---|---|---|
| Zahncreme | bis 0,15 | 2,25 (bei 1,5 g Zahncreme) |
| Kinderzahncreme | 0,05 | 0,25 (erbsengroße Menge, ca. 0,5 g) |
| Fluoridsalz | 0,031 | 0,62 (bei 2 g Salz) |
| Fluorid-Gelee | 1,25 | 12,5 (bei 1,0 g Gelee) |
| Touchierlösung | 1,0 | 5,0 (bei 0,5 ml Lösung) |
| Spüllösung | 0,025 | 2,5 (bei 10 ml Lösung) |
| Fluoridlack | 0,10–2,26 | 0,5–7,5 (bei 0,19–0,50 ml Lack) |
| Polierpaste | 0,1–3,0 | 1,0–30,0 (bei 1,0 g Paste) |
Fluorid kann sowohl topisch als auch systemisch verabreicht die Kariesprophylaxe unterstützen.[4] Diese Maßnahmen unterstützen seit Jahrzehnten die Kariesprophylaxe. Es wird angenommen, dass es bei Anwesenheit von Fluoriden in der Mundhöhle zu einer „beschleunigten“ Remineralisation mit Calcium- und Phosphationen aus dem Speichel kommt.[4] Das Bundesinstitut für Risikobewertung kam 2018 zu dem Schluss, dass es keine eindeutigen Belege dafür gebe, „dass eine Zahnpasta mit 500 ppm (= 500 mg/l) Fluorid (entspricht 0,05 % Fluoridanteil) weniger wirksam ist als eine mit 1000 ppm (0,1 % Fluorid)“.[5] Ein Cochrane-Report von 2019 weist darauf hin, dass Fluorid-enthaltene Zahnpasten erst ab einer Konzentration von 1000 ppm wirksam bei der Kariesprophylaxe sind.[6]
Der Fluoridgehalt bei Prophylaxeprodukten wie Zahnpasta wird als Salz angegeben, nicht für die Bewertung der Toxikologie (siehe unten) als Fluoridion.[3] Bei einem Produkt mit 5 % Natriumfluorid liegt die Fluoridmenge demnach bei 2,5 %.
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Bedarf
[Bearbeiten | Quelltext bearbeiten]Die empfohlene tägliche Gesamtaufnahme von Fluoriden liegt bei Erwachsenen bei etwa 3,5 mg[3], die geschätzte tatsächliche zwischen 0,4 und 1,5 mg.[7]
Laut einem im Jahr 2013 veröffentlichten Gutachten der Europäischen Behörde für Lebensmittelsicherheit (EFSA) ist Fluorid kein essentieller Nährstoff, da es weder Wachstumsprozessen noch der Zahnentwicklung dient und Zeichen eines Fluoridmangels nicht identifiziert werden konnten.[8]
Vorkommen und Aufnahme
[Bearbeiten | Quelltext bearbeiten]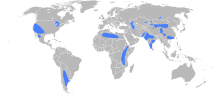
Grundsätzlich kommen Fluoride überall vor, auch im Grundwasser. In Deutschland beträgt der Fluoridgehalt im Trinkwasser überwiegend etwas weniger als 0,25 mg F− pro Liter.[3] In Gegenden mit hoher Fluorid-Mineraldichte (z. B. in Indien, China, Zentralafrika oder Südamerika) kann das Trinkwasser ca. 10 mg Fluoride pro Liter enthalten.[9] Durch das ubiquitäre Vorkommen im Grundwasser enthält praktisch die gesamte Vegetation Fluoride, getrockneter Tee durchschnittlich 100 mg/kg.[9] Damit werden sie über die Nahrung und mit dem Trinkwasser täglich aufgenommen (etwa 0,5–0,8 mg Fluorid).[10] Bei oraler Aufnahme erfolgt eine schnelle und nahezu vollständige Resorption löslicher Fluoride über die Magenschleimhaut, da die Salze durch die Salzsäure des Magens Fluorwasserstoff bilden, der als ungeladenes Molekül rasch resorbiert wird. Für diese Aufnahme spielt es keine Rolle, ob die Fluoride natürlicherweise in der Nahrung/Trinkwasser enthalten sind oder industriell ergänzt wurden (Fluoridierung).[9] Allgemein werden über die Nahrung 80 % aufgenommen, über die Lunge erfolgt eine Aufnahme nur in geringen Mengen.[3] Fluoride gelangen zu 60–80 % in den Blutkreislauf.[10] Dort befinden sich Fluoride überwiegend im Plasma (typische Konzentration 0,13–0,46 ppm bzw. mg/l, abhängig von der Fluoridaufnahme und den Knochenstoffwechsel), der Rest in den Erythrozyten.[3] Im Plasma beträgt die Halbwertszeit etwa 4 bis 10 Stunden. Vom Blut aus gelangen Fluoride in die Knochen und werden dort eingebaut.[10] Daher befindet sich der allergrößte Teil des Fluorides im menschlichen Körper in den Knochen und in den Zähnen (gerade an der Oberfläche sich entwickelnder Zähne), durchschnittlich hat jeder Mensch etwa 2,6 g Fluoride im Körper.[3] Bei Heranwachsenden wird die Hälfte des täglich aufgenommenen Fluorids im Skelett eingelagert, die andere Hälfte ausgeschieden (generell über die Nieren).[3] Das im Knochen befindliche Fluorid ist aber nicht irreversibel gebunden und wird bei geringerer Fluoridaufnahme auch wieder herausgelöst. Da die Plazenta nicht vollständig permeabel für Fluoride ist, liegt die Fluoridkonzentration im Blut des Fötus niedriger als die im Blut der Mutter. Muttermilch selbst enthält wenig Fluorid.[3] Der Speichel enthält vergleichsweise wenig Fluoride (0,05 ppm F−).[3]
Biologische Organofluoride
[Bearbeiten | Quelltext bearbeiten]
Natürlich vorkommende Organofluoride wurden auch in Mikroorganismen und Pflanzen nachgewiesen.[11][12] Hierbei kommt Fluoracetat am häufigsten vor, dieses dient als natürlicher Fraßschutz in manchen Pflanzen aus Afrika, Australien und Brasilien.[13] Daneben können Mikroorganismen Fettsäuren fluorieren, aber auch Fluoraceton oder 2-Fluorcitrat bilden.[14] In Bakterien wurde 2002 das Enzym Fluorinase entdeckt, das die Reaktion von S-Adenosylmethionin und Fluorid zu L-Methionin und 5'-Fluoro-5'-deoxyadenosin (5'-FDA) katalysiert.[15]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Die Toxikologie von Fluoriden ist von zahlreichen Faktoren abhängig, wie der Art des Fluorids, dessen Löslichkeitsverhalten (leicht löslich sind Natriumfluorid oder Zinnfluorid, schwerlöslich Calciumfluorid)[3], Art der Einwirkung, die Resorptionsgeschwindigkeit im Magen, dem Säure-Basen-Haushalt und dem pH-Wert des aufgenommenen Fluorids.
Als schwach dissoziiertes Molekül wird Fluorwasserstoff leicht durch die Haut aufgenommen. Es kommt zu schmerzhaften Entzündungen, später zu hartnäckigen, schlecht abheilenden Geschwüren.[16] Außerdem bildet HF starke Wasserstoffbrückenbindungen aus und ist so in der Lage, die Tertiärstruktur von Proteinen zu verändern.[17] Mit Aluminium-Ionen bildet Fluorid Fluoridoaluminat-Komplexe, die eine Phosphat-analoge Struktur haben und so zur Deregulierung von G-Proteinen beitragen.[18] Resultat ist ein Eingriff in die rezeptorgekoppelte Signalübertragung und – via signalabhängige Phosphorylierung/Dephosphorylierung – in die Aktivität vieler Enzyme. Bekanntestes Beispiel für eine Enzym-Hemmung durch Fluorid ist die Enolase, ein Enzym der Glykolysekette. Diese Hemmung macht man sich bei der Blutzuckermessung zu Nutze: Das im Entnahmeröhrchen vorgelegte Natriumfluorid hemmt den in-vitro Abbau der Glucose nach der Blutentnahme, sodass der später gemessene Wert dem tatsächlichen in-vivo Wert möglichst nahekommt.[19]
Die hochtoxischen Fluoracetate und Fluoracetamid werden nach der Resorption zu Fluorcitrat metabolisiert. Diese Verbindung führt zur Blockade des für den Citratzyklus wichtigen Enzyms Aconitase. Dies bewirkt eine Anreicherung von Citrat im Blut, was wiederum die Körperzellen von der Energiezufuhr abschneidet.[20] Perfluorierte Alkane, die als Blutersatzstoffe in der Erprobung sind, und die handelsüblichen Fluorcarbone, wie PTFE (Teflon), PVDF oder PFA gelten als ungiftig.
Akute Fluoridvergiftungen
[Bearbeiten | Quelltext bearbeiten]Die sicher toxische Dosis (certainly toxic dose, CTD) bzw. akut toxische Dosis liegt bei 32 bis 64 mg Fluorid pro Kilogramm Körpergewicht, bei einem 75 kg schweren Erwachsenen also bei etwa 3,5 g.[3] In der Literatur werden auch 5–10 g bei einem Erwachsenen angegeben.[3] Die sogenannte wahrscheinliche toxische Dosis (probably toxic dose, PTD) ist die Minimaldosis, bei der sich Toxizitäten und Symptome zeigen können, und die neben einer Einweisung in eine Klinik auch ein unmittelbares therapeutisches Eingreifen erfordert.[3] Sie liegt bei 5 mg Fluorid pro Kilogramm Körpergewicht[3]
Zum Vergleich: In einer Tube Zahnpasta (100 g bzw. 75 ml) mit einem Fluoridgehalt von 1000 ppm befinden sich 100 mg Fluorid. Ein 15 kg schweres Kind hätte beim Verzehr der gesamten Tube Zahnpasta die wahrscheinlich toxische Dosis damit überschritten. Unter häuslichen Bedingungen ist dies aber extrem unwahrscheinlich.[21]
Die Giftwirkung beruht teils auf der Ausfällung des vom Stoffwechsel benötigten Calcium als Calciumfluorid, teils aus der Wirkung als Protoplasma- und Zellgift, das bestimmte Enzymsysteme und die Proteinsynthese hemmt. Sie äußert sich in Schädigungen des Skeletts, der Zähne, der Lungenfunktion, der Haut und in Stoffwechselstörungen. Wasserunlösliche oder schwerlösliche Fluoride wie Calciumfluorid und Aluminiumfluorid besitzen eine wesentlich geringere Toxizität. Es besteht jedoch immer die Gefahr der Bildung des ebenfalls hochtoxischen Fluorwasserstoffs beim Kontakt mit starken Säuren.
Symptome einer akuten Fluoridvergiftung sind starke Schmerzen in Magen und Darm und hinter dem Brustbein, Krämpfe, Bewusstlosigkeit und schwere Stoffwechselstörungen. Fluorwasserstoff verursacht in höheren Konzentrationen starke Verätzungen bis zur Zerstörung von Zellen.
Als Antidot bei Fluoridvergiftungen dient Calciumgluconat.[22][23] Als Erste-Hilfe-Maßnahme sind auch andere calciumhaltige Mittel wirksam; beispielsweise kann es helfen, Milch zu trinken, um damit die Resorption der Fluoridionen zu hemmen.[24] Ferner beschleunigt eine hohe Flüssigkeitsaufnahme (über einen Tag) die Fluoridausscheidung über die Nieren.[21]
Chronische Fluoridvergiftungen
[Bearbeiten | Quelltext bearbeiten]Falls Fluoride chronisch aufgenommen werden, also über einen längeren Zeitraum, kann bereits eine geringere Dosis zu negativen Folgeerscheinungen führen (Fluorose).[25]
Die Aufnahme von mehr als 20 mg Fluorid pro Tag führt zu einer chronischen Fluoridvergiftung, die auch Fluorose genannt wird. Symptome sind Husten, Auswurf, Atemnot, eine Dentalfluorose mit Veränderung von Struktur und Farbe des Zahnschmelzes, eine Fluorosteopathie und teilweise eine Fluorokachexie. Die Fluorosteopathie führt durch Vermehrung des Knochengewebes zu Elastizitätsverlust und erhöhten Knochenbrüchigkeit (Osteosklerose) bis hin zum völligen Versteifen von Gelenken oder gar der Wirbelsäule.[16] Da gleichzeitig mit Hilfe hoher Fluoriddosen das Knochenwachstum stimuliert werden kann, verwendet man Fluoride zur Behandlung verschiedener Formen der Osteoporose.[16]
Natürliches Auftreten
[Bearbeiten | Quelltext bearbeiten]Bei Vulkanausbrüchen kann es zur Freisetzung größerer Mengen fluoridhaltiger Asche kommen. Dadurch können Grundwasser und Weideland großflächig kontaminiert werden.[26] Auf Island kam es in der Vergangenheit wiederholt zu Fällen von Fluorvergiftungen bei Weidetieren.[27]
Sonstige Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Frühere Studien untersuchten einen möglichen Zusammenhang von Fluoridaufnahme durch Trinkwasser und dem Auftreten von Osteosarkomen, einer Krebsart.[28] Mittlerweile gilt ein Zusammenhang als widerlegt.[29][30]
Arbeitsrecht
[Bearbeiten | Quelltext bearbeiten]Schäden, die durch die Arbeit mit Fluoriden entstehen, wie Skelettfluorose, Lungenschäden, Reizung des Magen-Darm-Trakts oder Verätzungen sind als Berufskrankheiten anerkannt. Im Berufskrankheiten-System sind sie unter Bk Nr. 13 08 erfasst.[31]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Wissenschaft-Online-Lexika: Eintrag zu Fluoride, in: Lexikon der Geologie, abgerufen am 10. Juli 2008.
- ↑ Biltz-Klemm-Fischer, 1966.
- ↑ a b c d e f g h i j k l m n o Jean-Francois Roulet, Susanne Fath, Stefan Zimmer: Zahnmedizinische Prophylaxe: Lehrbuch und Praxisleitfaden. 5. Auflage. Elsevier Health Sciences, 2017, ISBN 978-3-437-18744-5, S. 137 ff.
- ↑ a b Matthias Epple, Joachim Enax: Moderne Zahnpflege aus chemischer Sicht. In: Chemie in unserer Zeit. Band 52, Nr. 4, 2018, S. 218–228, doi:10.1002/ciuz.201800796.
- ↑ Für gesunde Zähne: Fluorid-Vorbeugung bei Säuglingen und Kleinkindern. (PDF) Stellungnahme Nr. 015/2018 des BfR. In: BfR. 31. Mai 2018, abgerufen am 7. September 2020.
- ↑ Tanya Walsh et al.: Fluoride toothpastes of different concentrations for preventing dental caries. In: The Cochrane Database of Systematic Reviews. Band 3, 4. März 2019, S. CD007868, doi:10.1002/14651858.CD007868.pub3, PMID 30829399, PMC 6398117 (freier Volltext).
- ↑ Zahnpasta - Fluorid und Zink – gefährlich? - Stiftung Warentest. In: Stiftung Warentest. 10. Oktober 2020, abgerufen am 10. Oktober 2020.
- ↑ Scientific Opinion on Dietary Reference Values for fluoride. In: EFSA Journal. Band 11, Nr. 8, 2013, S. 3332, doi:10.2903/j.efsa.2013.3332.
- ↑ a b c Guidelines for drinking-water quality, 4th edition, incorporating the 1st addendum. In: WHO. 24. April 2017, S. 370–373, abgerufen am 27. Oktober 2020 (englisch).
- ↑ a b c Johannes Einwag: Das sind die Fakten. Die neuen Fluoridempfehlungen. In: Zahnärztliche Mitteilungen. 16. November 2019, abgerufen am 12. September 2020.
- ↑ Gordon W. Gribble: Naturally Occurring Organofluorines. In: Organofluorines (= The Handbook of Environmental Chemistry). Springer, Berlin, Heidelberg 2002, ISBN 978-3-540-44975-1, S. 121–136, doi:10.1007/10721878_5.
- ↑ Xinkuan Cheng, Long Ma: Enzymatic synthesis of fluorinated compounds. In: Applied Microbiology and Biotechnology. Band 105, Nr. 21-22, November 2021, S. 8033–8058, doi:10.1007/s00253-021-11608-0, PMID 34625820, PMC 8500828 (freier Volltext).
- ↑ Alex T. Proudfoot et al.: Sodium fluoroacetate poisoning. In: Toxicological Reviews. Band 25, Nr. 4, 2006, S. 213–219, doi:10.2165/00139709-200625040-00002, PMID 17288493.
- ↑ Cormac D. Murphy et al.: Fluorinated natural products: the biosynthesis of fluoroacetate and 4-fluorothreonine in Streptomyces cattleya. In: Chemosphere. Band 52, Nr. 2, Juli 2003, S. 455–461, doi:10.1016/S0045-6535(03)00191-7, PMID 12738270.
- ↑ David O'Hagan et al.: Biochemistry: biosynthesis of an organofluorine molecule. In: Nature. Band 416, Nr. 6878, 21. März 2002, S. 279, doi:10.1038/416279a, PMID 11907567.
- ↑ a b c W. Forth et al.: Allgemeine und spezielle Pharmakologie und Toxikologie. 8. Auflage. Urban & Fischer, München 2001, ISBN 3-437-42520-X.
- ↑ S. L. Edwards et al.: The crystal structure of fluoride-inhibited cytochrome c peroxidase. In: Journal of Biological Chemistry. Band 259, Nr. 21, 1984, S. 12984–12988 (PDF).
- ↑ A. Lubkowska et al.: Interactions between fluorine and aluminium. In: Fluoride. Band 35, Nr. 2, 2002, S. 73–77 (PDF).
- ↑ Raymond Gambino, David E. Bruns: Stabilization of glucose in blood samples: out with the old, in with the new. In: Clinical Chemistry and Laboratory Medicine. Band 51, Nr. 10, 1. Oktober 2013, S. 1883–1885, doi:10.1515/cclm-2013-0341.
- ↑ A. T. Proudfoot et al.: Sodium Fluoroacetate Poisoning. In: Toxicological Reviews. Band 25, Nr. 4, 2006, S. 213–219, PMID 17288493.
- ↑ a b Klaus-Dieter Hellwege: Die Praxis der zahnmedizinischen Prophylaxe: Ein Leitfaden für die Individualprophylaxe für Zahnärzte und Mitarbeiter. 7. Auflage. Thieme, 2018, ISBN 978-3-13-127187-7, S. 216.
- ↑ Eintrag zu Antidot. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. November 2013.
- ↑ Eintrag zu Gluconate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. November 2013.
- ↑ Jürgen Stein (Hrsg.): Praxishandbuch klinische Ernährung und Infusionstherapie. Springer 2003, ISBN 978-3-642-55896-2, S. 120, eingeschränkte Vorschau in der Google-Buchsuche
- ↑ G.M. Whitford: The Metabolism and Toxicity of Fluoride. Monographs in Oral Science (Editor Howard M. Myers) Vol. 13, Karger, Basel 1989
- ↑ Dagmar Trodler: Fluorbelastung an der Eruptionsstelle. In: Iceland Review. 31. März 2021, abgerufen am 17. März 2024 (deutsch).
- ↑ Faszinierende Fakten über Islands Vulkane. Abgerufen am 17. März 2024 (englisch).
- ↑ E. B. Bassin et al.: Age-specific fluoride exposure in drinking water and osteosarcoma (United States). In: Cancer Causes & Control. Band 17, 2006, S. 421–428, doi:10.1007/s10552-005-0500-6.
- ↑ Brock A. Lindsey et al.: Osteosarcoma Overview. In: Rheumatology and Therapy. Band 4, Nr. 1, 8. Dezember 2016, S. 25–43, doi:10.1007/s40744-016-0050-2, PMID 27933467, PMC 5443719 (freier Volltext).
- ↑ Jean-Francois Roulet, Susanne Fath, Stefan Zimmer: Zahnmedizinische Prophylaxe: Lehrbuch und Praxisleitfaden. 5. Auflage. Elsevier Health Sciences, 2017, ISBN 978-3-437-18744-5, S. 141 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 26. März 2022]).
- ↑ Helmut Valentin, Gerhard Lehnert, Heinrich Petry: Arbeitsmedizin I. Arbeitsphysiologie und Arbeitshygiene. Grundlagen für Prävention und Begutachtung. 3. Auflage. Georg Thieme Verlag, Stuttgart 1985, ISBN 3-13-572003-9.



