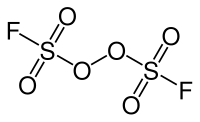
Peroxydisulfuryldifluorid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Peroxydisulfuryldifluorid | ||||||||||||
| Summenformel | F2O6S2 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 198,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
1,6450 g·cm−3 (35,5 °C)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
67,1 °C[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Peroxydisulfuryldifluorid ist eine anorganische chemische Verbindung aus der Gruppe der Peroxide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Peroxydisulfuryldifluorid kann durch die Reaktion von Schwefeltrioxid mit Fluor in Gegenwart von Silber(II)-fluorid oder durch Elektrolyse von Fluorschwefelsäure gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Chrom(V)-fluorid mit Schwefeltrioxid[5]
oder durch die Reaktion zwischen Fluorschwefelsäure und Dioxygenylhexafluorarsenat.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Peroxydisulfuryldifluorid ist eine farblose Flüssigkeit mit unangenehmem Geruch, die durch Wasser hydrolysiert wird, wobei Sauerstoff und Fluorschwefelsäure entstehen. Die Verbindung kann organische Materialien bei Kontakt entzünden.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Peroxydisulfuryldifluorid kann zur Herstellung von Fluorosulfaten verwendet werden. Es ist ein starkes Oxidationsmittel und kann für die Oxidation von Edelmetallen (Ag, Au, Re, Pt, Os, Rh) zu den Salzen der Fluorschwefelsäure verwendet werden.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Nikolai S. Zefirov: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2001, ISBN 978-0-471-93623-7, Peroxydisulfuryl Difluoride, S. rp044, doi:10.1002/047084289x.rp044.
- ↑ F. B. Dudley, G. H. Cady: Peroxydisulfuryl Difluoride. In: Journal of the American Chemical Society. Band 79, Nr. 3, 1957, S. 513–514, doi:10.1021/ja01560a002.
- ↑ Jean' Ne M. Shreeve, George H. Cady, Charles Cleaver, E. L. Muetterties: Inorganic Syntheses. John Wiley & Sons, Inc., Hoboken, NJ, USA 2007, ISBN 978-0-470-13238-8, Peroxydisulfuryl Difluoride, S. 124–128, doi:10.1002/9780470132388.ch34.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. D. Brown, G. L. Gard: A new preparation of peroxydisulfuryl difluoride. In: Inorganic and Nuclear Chemistry Letters. Band 11, Nr. 1, 1975, S. 19–21, doi:10.1016/0020-1650(75)80140-1.
- ↑ Andrej Šmalc, Steven G. Mayorga, Neil Bartlett: Inorganic Syntheses. John Wiley & Sons, Inc., Hoboken, NJ, USA 2007, ISBN 978-0-470-13260-9, Peroxydisulfuryl Difluoride (Modification), S. 10–11, doi:10.1002/9780470132609.ch5.


![{\displaystyle {\ce {2HSO3F + 2[O2][AsF6] -> S2O6F2 + 2O2 + 2AsF5 + 2HF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8906a465cd948b606ae1f15d28e3dacde8b8bd95)