Tellurtetrafluorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Te4+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Tellurtetrafluorid | |||||||||
| Andere Namen |
Tellur(IV)-fluorid | |||||||||
| Verhältnisformel | TeF4 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 203,59 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
4,22 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
374 °C[3] | |||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Tellurtetrafluorid ist eine chemische Verbindung des Tellurs aus der Gruppe der Fluoride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tellurtetrafluorid kann durch Reaktion von Tellurdioxid mit Schwefeltetrafluorid unter Druck gewonnen werden.[5] Ebenfalls möglich ist die Darstellung aus den Elementen oder durch thermische Zersetzung von Natrium- oder Kaliumfluorokomplexen NaTeF5 bzw. KTeF5 bei 450 bis 600 °C.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tellurtetrafluorid ist ein farbloser Feststoff, der sich bei Kontakt mit Wasser zersetzt. Ab einer Temperatur von 195 °C zersetzt er sich langsam zu Tellurhexafluorid.[3]
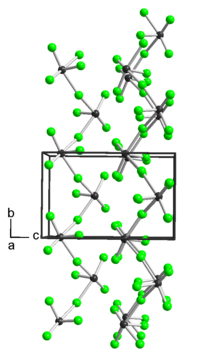
In flüssiger Form leitet die Verbindung elektrischen Strom. Der Dampf der Verbindung hat eine rote Farbe. In fester Form besitzt sie eine polymere Struktur TeF3-F-... die über die Fluoratome verbunden ist. Sie greift Glas, Kupfer, Nickel, Gold, Quecksilber bei Temperaturen um ihren Zersetzungspunkt an.[5][3] Tellurtetrafluorid besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19) und den Gitterparametern a=536 pm, b=622 pm und c=964 pm.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Tellurtetrafluorid kann als Fluorierungsmittel und Fluoridierungsmittel verwendet werden.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, S. 94 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker, Band 3, S. 758; ISBN 3-540-60035-3
- ↑ a b c d e A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 632.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, S. 3195 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. J. Edwards, F. I. Hewaidy: Fluoride crystal structures. Part IV. Tellurium tetrafluoride. In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1968, S. 2977, doi:10.1039/J19680002977.
