Amidophosphoribosyltransferase
Zur Navigation springen
Zur Suche springen
| Amidophosphoribosyltransferase | ||
|---|---|---|

| ||
| Bändermodell des PPAT-Tetramers von E. coli, nach PDB 1ECB | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 506 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, -tetramer | |
| Kofaktor | Mg2+, (4Fe-4S) | |
| Präkursor | (517 aa) | |
| Bezeichner | ||
| Gen-Name | PPAT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.4.2.14, Transferase | |
| Reaktionsart | Übertragung eines Riboserests | |
| Substrat | Glutamin + PRPP + H2O | |
| Produkte | Glutaminsäure + PPi + 5-Phosphoribosylamin | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
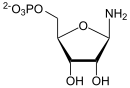
Die Amidophosphoribosyltransferase (ATase), auch GPAT genannt, ist das Enzym, das einen Amidrest von Glutamin auf PRPP überträgt und dabei Pyrophosphat abspaltet. Dieser Reaktionsschritt in der Purinbiosynthese aller Lebewesen ist festlegend, das heißt, aus den Produkten dieser und der nächsten Reaktionen kann von nun an nur noch IMP hergestellt werden. Die ATase ist im Zytosol lokalisiert, kommt in allen Gewebetypen vor und benötigt als Cofaktoren Magnesium und einen Eisen-Schwefel-Cluster.[1]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]Aus PRPP und Glutamin entsteht 5-Phosphoribosylamin (PRA) und Glutamat. Die im Gleichgewicht befindliche Reaktion wird durch Hydrolyse des Diphosphats stark nach rechts verschoben. Als Hemmstoffe fungieren IMP, GMP und AMP.[2]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Purin-Stoffwechsel – Lern- und Lehrmaterialien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt Q06203
- ↑ Jassal/reactome: 5-phospho-alpha-D-ribose 1-diphosphate (PRPP) + H2O + L-glutamine ⇔ 5-phosphoribosylamine + L-glutamate + pyrophosphate. Abgerufen am 18. Januar 2021.