Ammonium


Das Ammonium-Ion NH4+ (nach IUPAC auch Azanium-Ion[1]) ist ein Kation, das sich in einer Säure-Base-Reaktion aus der gasförmigen Base Ammoniak durch Anlagerung eines Protons an das freie Elektronenpaar bildet. Damit ist aus chemischer Sicht das Ammonium-Kation die konjugierte Säure der mittelstarken Base Ammoniak (NH3), das als gasförmige Verbindung im natürlichen Stickstoffkreislauf entsteht und in der Erdatmosphäre sowie protoniert als Ammonium-Kation im Boden eine wichtige Rolle spielt. Mit einem pKS-Wert von 9,25 ist das Ammonium-Kation eine schwache bis mittelstarke Säure.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bildung von Salzen und Salzlösungen
[Bearbeiten | Quelltext bearbeiten]Wie andere Kationen kann auch das Ammonium-Kation mit Anionen Salze bilden. Solche Ammoniumsalze können z. B Salze mit Anionen von starken anorganischen Säuren sein, wie z. B Ammoniumchlorid (NH4Cl, auch genannt Salmiak) oder das vielfach industriell verwendete Ammoniumsulfat, oder die gefährlichen Sprengstoffe Ammoniumnitrat (NH4NO3) und Ammoniumdichromat. Auch Ammonium-Salze mit Anionen organischer oder schwacher Säuren wie z. B Ammoniumacetat oder Ammoniumcarbonat, sind bekannt und werden vielfach auch in der Lebensmittelchemie eingesetzt.
Ein Ammonium-Ion ist tetraedisch aufgebaut. In wässerigen Lösungen stehen Ammoniumkationen in einem Dissoziationsgleichgewicht mit Ammoniak und Oxonium-Kationen (Hydroxonium-kationen). Damit ist die Lage dieses Gleichgewichts vom pH-Wert abhängig. Die Konzentration des Ammoniaks steigt mit zunehmendem pH-Wert und steigender Temperatur.
Der pKs-Wert des Kations Ammonium beträgt 9,25. Damit sind Ammoniumsalze einerseits schwache Säuren, jedoch kommt es hinsichtlich der Auswirkung auf den pH-Wert einer Lösung auch auf die Art des Anions an. Da z. B. im Salz Ammoniumsulfat das Sulfatanion als Anion einer starken Säure nur eine sehr schwache Base ist, erklärt sich für das Salz Ammoniumsulfat und auch für andere Ammoniumsalze mit Anionen von starken Säuren folgender Befund: Ammoniumsalze mit Anionen starker Säuren reagieren in wässriger Lösung als schwache Säuren und bilden leicht saure Lösungen. Wenn jedoch wie z. B. im Salz Ammoniumcarbonat das Carbonatanion als Anion einer schwachen Säure eine mittelstarke Base ist, dann zeigt sich bei der Auflösung dieser Salze kaum eine Änderung des pH-Wertes, da sich die Einflüsse kompensieren.[3]
Redoxreaktionen
[Bearbeiten | Quelltext bearbeiten]Das N-Atom im Ammonium-Kation von Ammoniumsalzen befindet sich im niedrigst möglichen Oxidationszustand, wird aber unter Normalbedingungen von üblichen Oxidationsmitteln nicht angegriffen, wenn sie zugegeben werden. Wenn aber ein Oxidationsmittel wie z. B ein Chromatanion oder ein Nitratanion von vornherein als Anion Bestandteil des Ammoniumsalzes ist, dann ist das Stickstoffatom im Ammoniumnitrat gegen einen oxidativen Angriff dieses Anions sehr empfindlich. Das Ammoniumkation wird in diesen Fällen so leicht vom eigenen Anion zu Stickstoff oxidiert, dass eine Redoxreaktion nach Zündung als heftige, allein fortschreitende Verbrennung abläuft, wie z. B. im Fall des Salzes Ammoniumdichromat. Die spektakulär ablaufende thermische Zersetzung dieses Ammoniumsalzes verläuft nach der Reaktionsgleichung.[2]
Im Fall des Salzes Ammoniumnitrat, das als Düngemittel in großen Mengen gelagert wird, kann die Reaktion sogar ohne Zündung spontan und explosionsartig erfolgen. Typische Beispiele dafür sind mehrere beschriebene katastrophal verlaufene, Ammoniumnitrat-Katastrophen, die durch folgende chemische Reaktionsgleichung beschrieben werden.
Sonstige Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumsalze werden manchmal vereinfachend als Pseudoalkalisalze bezeichnet. Die Aussage ist aber nur auf die mit Alkalimetallsalzen vergleichbaren Eigenschaften hinsichtlich der Größe der Ionen und der Löslichkeit der Salze in Wasser zurückzuführen, was für chemische Eigenschaften nicht von großer Bedeutung ist, wohl aber für physiologische Eigenschaften und Wirkungen. Die Ähnlichkeiten sind zu erklären durch einen bei gleicher Ladung nahezu gleichen Ionenradius der Alkalisalze.[4]
- Siehe auch: Grimmscher Hydridverschiebungssatz
Ammonium in der Natur
[Bearbeiten | Quelltext bearbeiten]Die natürliche Bildung von Ammoniak (bzw. protoniert Ammonium) erfolgt aus dem Stickstoff in der Luft. Dabei handelt es sich um einen grundlegenden und sehr energieaufwändigen, vom Enzym Nitrogenase katalysierten Schritt im Verlauf des vielstufigen Prozesses der sog. biotischen Stickstofffixierung im natürlichen Stickstoffkreislauf, der mit Hilfe von Nitratbakterien bis zur Bildung von Nitraten führt.[Anm. 1]
In der Natur entstehen Ammoniumkationen hauptsächlich als Endprodukte beim Abbau von Proteinen. Sie können von Fischen und anderen Wasserorganismen als gasförmig, z. B. über die Kiemen ausgeschieden werden. Auch bei der bakteriellen Verrottung abgestorbener Biomasse wird Ammoniak als Endprodukt freigesetzt. Ammoniak spielt eine wichtige Rolle im Citratzyklus, bei dem es mit α-Ketoglutarat zur Glutaminsäure reagiert.
Ammonium wird im Boden und in Gewässern unter Sauerstoffverbrauch bakteriell (u. a. Nitrosomonas) zuerst zu Nitrit und von einer anderen Bakterienart (u. a. Nitrobacter) weiter zu Nitrat oxidiert und damit „entgiftet“ bzw. nutzbar gemacht. Neben Bakterien spielen auch Archaea bei der Ammoniumoxidation im Boden eine wichtige Rolle.[5] Dieser Vorgang wird Nitrifikation genannt und ist im Boden erwünscht. Auch in Gewässern ist die Nitrifikation ein wichtiger Teil der Selbstreinigung.
Ammoniak ist für Fische schon in geringen Konzentrationen giftig. Ammoniumgehalte im Wasser von 0,5 bis 1 mg/l werden deshalb, je nach dem pH-Wert des Wassers, als bedenklich für Fische eingestuft. Bei Ammoniumgehalten von über 1 mg/l ist ein Gewässer für Fischereizwecke nicht geeignet.
Physiologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Das Ammonium-Kation ähnelt dem Kalium-Kation (K+) in Größe und Ladung und kann daher im Organismus dessen Stelle einnehmen. Da es aber anders reagiert, kann es z. B. von Synapsen, die kaliumgesteuert sind, nicht wieder abgespalten werden und blockiert die Synapsen dann dauerhaft. Ammonium wirkt deshalb in allen Organismen mit kaliumgesteuerten Synapsen als Nervengift.[6]
Ammoniumkationen entstehen bei Stoffwechselvorgängen in der Leber beim biochemischen Abbau von Aminosäuren. Der erste Schritt dieser Reaktion ist die sog. Desaminierung der Aminosäuren. Diese Reaktion muss in der Leber so verlaufen, dass kein zelltoxisches Ammoniak entsteht, sondern nur Ammoniumkationen. In der Leber erfolgt die Bildung von Harnstoff durch Reaktion von Ammonium (NH4+) mit Hydrogencarbonat (HCO3-) im sog. Harnstoffzyklus. Der gebildete Harnstoff wird im Urin ausgeschieden. Ammoniumkationen können auch direkt im Urin ausgeschieden werden, was dann auf Konkremente hinweist.
Bei Vögeln und bei an Land lebenden Echsen wird statt Harnstoff Harnsäure produziert und ausgeschieden. Fische benötigen zur Ausscheidung keine Umwandlung von Ammoniak in Harnstoff, denn bei Fischen bietet sich über die Haut und die Kiemen mit direktem Kontakt zum Wasser ein einfacher Weg zur Ausscheidung über Osmose an.
Verwendung
[Bearbeiten | Quelltext bearbeiten]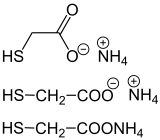 |
Ammoniumsalze sind wichtige Verbindungen im Bereich der produzierenden anorganischen chemischen Industrie. Sie werden im Megatonnenmaßstab produziert und überwiegend als Düngemittel eingesetzt. Im geringeren Umfang werden sie auch in Trockenbatterien eingesetzt und zur Herstellung von Farbstoffen benötigt.
Das Ammoniumsalz der Thioglykolsäure wird im Friseurhandwerk als Reduktionsmittel in der Dauerwelle benutzt. Das Ammoniumsalz der Thiomilchsäure ist ein weiteres Beispiel für den Einsatz eines Ammoniumsalzes im Friseurhandwerk.[7]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Zur schnellen Prüfung (Vorprobe) einer Substanz auf das Vorhandensein von Ammoniumkationen versetzt man eine Probe der Substanz mit etwas Natronlauge oder mit etwas festem Natriumhydroxid und wenig Wasser. Das aus den Ammoniumkationen freigesetzte gasförmige Ammoniak ist entweder zu riechen oder man weist es anhand der basischen Verfärbung eines feuchten pH-Teststreifens über dem Reaktionsgemisch (Kreuzprobe) nach.
Ein empfindlicher Nachweis ist die Reaktion mit Nesslers Reagenz, das allerdings auch auf Amine anspricht.[8] Eine empfindliche und selektive quantitative Bestimmung erfolgt nach DIN meist mithilfe der Berthelot-Reaktion unter Bildung eines blauen Indophenols, dessen Konzentration colorimetrisch bestimmt werden kann.
Verschiedene Salztypen
[Bearbeiten | Quelltext bearbeiten]Organische Salze
[Bearbeiten | Quelltext bearbeiten]- Mono-, Di- und Tri- alkylierte Ammoniumsalze, wie z. B. Methylammoniumchlorid, Dimethylammoniumchlorid und Trimethylammoniumchlorid (bzw. Trimethylamin-Hydrochlorid, siehe Hydrochloride)
- Als quartäre Ammoniumverbindungen, z. B. Tetramethylammoniumchlorid, werden organische Ammonium-Salze bezeichnet, bei denen das Stickstoffatom vier organische Reste trägt
- organische Restiden.
- Zu der sehr umfangreichen und variablen Gruppe der salzartigen quartären Ammoniumverbindungen gehören auch cyclische, N-alkylierte Heteroaromatische Verbindungen, wie z. B. Pyridiniumverbindungen
Doppelsalze
[Bearbeiten | Quelltext bearbeiten]Das sog. Mohrsche Salz, Ammoniumeisen(II)-sulfat, ist ein Doppelsalz mit zwei verschiedenen Kationen, aber zwei gleichen Anionen. Neben zwei Ammonium-Kationen hat es ein Eisen(II)-Kation und zur Ladungskompensation zwei Sulfat-Anionen. Das ergibt die Summenformel: (NH4)2Fe(SO4)2 Auch ein angebliches Doppelsalz Ammoniumsulfatnitrat mit den zwei verschiedenen Anionen Nitrat und Sulfat und mit Ammonium-Kationen zur Ladungskompensation wird als Düngemittel eingesetzt. Es war jedoch lange unklar, ob es sich um eine echte Verbindung handelt, oder nur um eine äquimolare Mischung der beiden Einzelsalze.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Die großtechnische Umwandlung von Luft-Stickstoff in Ammoniak erfolgt mit dem Haber-Bosch-Verfahren
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ G. J. Leigh (Hrsg.): Principles of chemical nomenclature. A guide to IUPAC recommendations. The Royal Society of Chemistry, Cambridge 2011, S. 46.
- ↑ a b M. Binnewies et al.: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6. S. 478 f.
- ↑ Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 804 f.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 654.
- ↑ Scinexx.de: Urbakterien als „Ammonium-Killer“. Abgerufen am 31. Januar 2013.
- ↑ Robert Guderian (Hrsg.): Handbuch der Umweltveränderungen und Ökotoxikologie - Band 1A, Springer, Berlin 2000, ISBN 978-3-540-66184-9.
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Vieweg + Teubner Verlag (2011) S. 165, ISBN 978-3-8348-1245-2.
- ↑ E. Schweda: Jander, Blasius: Anorganische Chemie I – Einführung & Qualitative Analyse. 17. Auflage. Hirzel, 2012, ISBN 978-3-7776-2134-0. S. 294.


