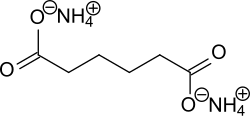
Ammoniumadipat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumadipat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H16N2O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 180,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Löslichkeit |
399,7 g·l−1 (14 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ammoniumadipat ist eine chemische Verbindung aus der Gruppe der Carbonsäurensalze und das Ammoniumsalz der Adipinsäure.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Ammoniumadipat kann durch Eindampfen einer Lösung von Adipinsäure in überschüssigem Ammoniak hergestellt werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumadipat kristallisiert ohne Kristallwasser in glänzenden Blättchen[1] im monoklinen Kristallsystem in der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 615,0 pm, b = 889,7 pm, c = 869,0 pm und β = 98,21°. In der Elementarzelle befinden sich zwei Formeleinheiten.[4]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Beim Erhitzen auf 100 °C entweicht die Hälfte des Ammoniaks und es bildet sich Ammoniumhydrogenadipat. Bei 120 − 150 °C entweicht auch der restliche Ammoniak und die reine Säure bleibt zurück.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Ammoniumadipat wird als Säureregulator verwendet. Es ist als Lebensmittelzusatzstoff unter der INS-Nummer 359 registriert.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e W. Dieterle, C. Hell: "Zur Kenntnis der Adipinsäure" in Ber. d. dt. chem. Ges. 1884, 17, S. 2221–2228. Volltext
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ V. F. Ushakov, K. I. Livshits, N. I. Geraskina, A. S. Litman, V. I. Kucher, T. G. Vasiltsova, A. P. Korolev, L. A. Palienko, A. Ia Sharipkina, N. P. Grisha: Ammonium adipate toxicity. In: Meditsina Truda I Promyshlennaia Ekologiia. Nr. 1, 1993, S. 45–47, PMID 8075940.
- ↑ I. A. Teslya, A. I. Tursina, L. D. Iskhakova, L. M. Avdonina, V. V. Marugin: "Crystal structure and thermal stability of ammonium adipate (NH4)2C6H8O4" in Journal of Structural Chemistry 1990, 31(6), S. 956–960. doi:10.1007/BF00752171
- ↑ CLASS NAMES AND THE INTERNATIONAL NUMBERING SYSTEM FOR FOOD ADDITIVES CXG36-1989. (PDF) Adopted in 1989. Revised in 2008. Amended in 2018, 2019, 2021. In: Codex Alimentarius. FAO, 2021, abgerufen am 17. Juni 2023.
