Ammoniumpermanganat
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
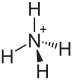 
| ||||||||||
| Allgemeines | ||||||||||
| Name | Ammoniumpermanganat | |||||||||
| Summenformel | NH4MnO4 | |||||||||
| Kurzbeschreibung |
dunkel violetter Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 137 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
2,22 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Wasser (80 g·l−1 bei 15 °C, 86 g·l−1 bei 25 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Ammoniumpermanganat ist eine anorganische chemische Verbindung des Mangans aus der Gruppe der Permanganate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ammoniumpermanganat kann durch Reaktion von Bariumpermanganat mit Ammoniumsulfat gewonnen werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumpermanganat ist ein dunkelvioletter Feststoff, der löslich in Wasser ist.[1] Er ist stoßempfindlich und zersetzt sich bei Raumtemperatur langsam. Er besitzt eine orthorhombische Kristallstruktur vom Baryt-Typ mit der Raumgruppe Pnma (Raumgruppen-Nr. 62) und den Gitterparametern a = 9,410 Å, b = 5,773 Å und c = 7,610 Å.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 0-8493-8671-3, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ László Kótai, Piroska Szabó, Ágnes Keszler: Studies on the thermal behavior of ammonium permanganate. In: Thermochimica Acta. 338, 1999, S. 129, doi:10.1016/S0040-6031(99)00212-9.
- ↑ Laszlo Kotai, Istvan Gacs, Istvan E. Sajo, Pradeep K. Sharma, Kalyan K. Banerji: ChemInform Abstract: Beliefs and Facts in Permanganate Chemistry - An Overview on the Synthesis and the Reactivity of Simple and Complex Permanganates. In: ChemInform. 42, 2011, S. no, doi:10.1002/chin.201113233.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b F. M. Chang, M. Jansen: Ammoniumpermanganat. In: Acta Crystallographica Section C Crystal Structure Communications. 41, S. 1693, doi:10.1107/S010827018500909X.
