Aniracetam
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Aniracetam | |||||||||||||||||||||
| Andere Namen |
1-(4-Methoxybenzoyl)pyrrolidin-2-on (IUPAC) | |||||||||||||||||||||
| Summenformel | C12H13NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 219,24 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in Toluol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Aniracetam (Handelsname: Ampamet (I, a.H.), Hersteller: Menarini) ist ein Piracetam-ähnlicher Arzneistoff aus der Gruppe der Nootropika zur Verbesserung der der kognitiven Funktionen.[4]
Darstellung und Gewinnung
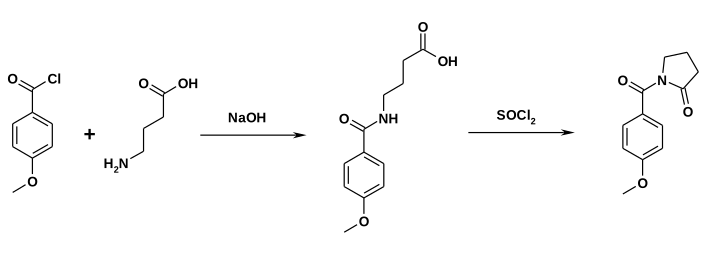
[Bearbeiten | Quelltext bearbeiten]Der Wirkstoff wurde in den 1970er Jahren bei Hoffmann-La Roche entwickelt.[5][6] Eine Synthese geht vom Anisoylchlorid aus, welches in Gegenwart von Triethylamin mit 2-Pyrrolidon umgesetzt wird.[7]
Bei einer alternativen Synthese wird Anisoylchlorid zunächst mit 4-Aminobuttersäure umgesetzt. Der Ringschluss erfolgt dann durch die Reaktion mit Thionylchlorid.[7]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Aniracetam liegt als weißes kristallines Pulver vor.[1] Es ist geruchlos und hat einen bitteren Geschmack. Die Löslichkeit in Wasser beträgt 453 g/L[8], in DMSO 44 g/L, in Ethanol 11 g/L.[9][10]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Oral verabreichtes Aniracetam wurde in klinischen Studien in Tagesdosen von 1000 bis 1500 mg zur Behandlung von kognitiven Beeinträchtigungen bei Patienten mit seniler Demenz vom Alzheimer-Typ und in Tagesdosen von 600 bis 1500 mg zur Behandlung verschiedener Symptome einschließlich Gedächtnisstörungen bei älteren Patienten mit zerebrovaskulären Erkrankungen eingesetzt.[4]
Mögliche Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]- Benommenheit
- Koordinationsstörungen
- Kopfschmerzen
- kognitive Störungen
- Nervosität
- Gleichgewichtsstörung
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Aniracetam, >98.0% bei TCI Europe, abgerufen am 12. November 2023.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 108.
- ↑ a b c Datenblatt Aniracetam bei Sigma-Aldrich, abgerufen am 16. Juni 2011 (PDF).
- ↑ a b C. R. Lee, P. Benfield: Aniracetam. An overview of its pharmacodynamic and pharmacokinetic properties, and a review of its therapeutic potential in senile cognitive disorders. In: Drugs & Aging. Band 4, Nr. 3, 1994, S. 257–273, doi:10.2165/00002512-199404030-00007, PMID 8199398.
- ↑ Patent EP 5 143 Hoffmann-La Roche 1978.
- ↑ Patent EP 44 088 Hoffmann-La Roche 1978.
- ↑ a b A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme 2001, ISBN 3-13-115134-X.
- ↑ Sebastian D. Goldsmith, Arlene McDowell: Designing a Formulation of the Nootropic Drug Aniracetam Using 2-Hydroxypropyl-β-Cyclodextrin Suitable for Parenteral Administration. In: Pharmaceutics. Band 10, Nr. 4, 2018, S. 240, doi:10.3390/pharmaceutics10040240, PMID 30453664, PMC 6320825 (freier Volltext).
- ↑ Selleck Chemical: Aniracetam Datasheet, abgerufen am 12. November 2023
- ↑ Danfeng Shao, Zehui Yang, Guoquan Zhou: Aniracetam Solubility in Pure and Binary Solvents: Effect of Molecular Interaction and Analysis of Crystallized Products. In: Journal of Chemical & Engineering Data. Band 63, Nr. 8, 2018, S. 2681–2688, doi:10.1021/acs.jced.8b00023.