Bariumselenat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumselenat | |||||||||||||||
| Andere Namen |
Bariumselenat(VI) | |||||||||||||||
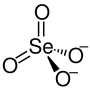
| Summenformel | BaSeO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 280,28 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,75 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bariumselenat ist eine anorganische chemische Verbindung des Bariums aus der Gruppe der Selenate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bariumselenat kann durch Reaktion von Natriumselenat mit Bariumchlorid in einer wässrigen Lösung gewonnen werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumselenat ist ein weißer Feststoff, der schwer löslich in Wasser ist.[1] Bei Erhitzung über 425 °C zersetzt sich die Verbindung. Mit Bariumdiselenat BaSe2O7 ist auch noch ein weiteres Bariumselenat bekannt.[5] Er besitzt eine orthorhombische Kristallstruktur vom Baryttyp mit der Raumgruppe Pnma (Raumgruppen-Nr. 62) (a = 8,993 Å, b = 5,675 Å, c = 7,349 Å).[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bariumselenat wurde als eine „slowrelease“-Selenquelle für Futterpflanzen für Weidetiere verwendet und sollte die Selenversorgung von Weidetieren sicherstellen.[7] In der Schweiz und der EU ist die direkte Verwendung als Futterzusatz verboten.[8][9] Durch Reduktion von Bariumselenat im Wasserstoffstrom kann Bariumselenid gewonnen werden.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Bariumselenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Mai 2017. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-50.
- ↑ Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 190 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter die Gruppeneinträge zu barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex und selenium compounds with the exception of cadmium sulphoselenide and those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 18. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 184 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Andara, M. A. Salvado, Á. Fernández-González, S. García-Granda, M. Prieto: Crystal structure of barium selenate, BaSeO4. In: Zeitschrift für Kristallographie – New Crystal Structures. 220, 2005, doi:10.1524/ncrs.2005.220.14.5.
- ↑ lfl.bayern.de: AGGF Tagungsband Nährwert und Milchproduktionspotential des Futters von Grünland – Einfluss der Applikation eines selenhaltigen Kalkgranulates auf die Selen-Konzentrationen in Weideaufwüchsen und die Glutathionperoxidase-Aktivität von Rindern unterschiedlicher Rassen, H. Laser, M. Behrendts und B. Tönepöhl, abgerufen am 15. Juni 2016
- ↑ Eintrag zu Bariumselenat bei Vetpharm, abgerufen am 15. Juni 2016.
- ↑ Durchführungsverordnung (EU) 2015/446 der Kommission vom 17. März 2015 zur Änderung der Verordnung (EU) Nr. 37/2010 hinsichtlich des Stoffs „Bariumselenat“, abgerufen am 15. Juni 2016. In: Amtsblatt der Europäischen Union. L, Nr. 74, 18. März 2015, S. 18–20.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 949.




