Bariumstannat
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
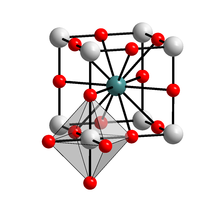
| ||||||||||||||||
| _ Ba2+ _ Sn4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumstannat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | BaSnO3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 304,04 g·mol−1 | |||||||||||||||
| Dichte |
7,24 g·cm−3[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bariumstannat ist eine anorganische chemische Verbindung des Bariums aus der Gruppe der Stannate. Es existieren mit BaSnO3, Ba3Sn2O7 und Ba2SnO4 drei Oxostannat-(IV)-Verbindungen im BaO-SnO2-Binärsystem, aber als Bariumstannat wird normalerweise BaSnO3 bezeichnet, weil unter diesen BaSnO3 die bekannteste, die am besten untersuchte und die nützlichste Verbindung ist.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bariumstannat kann durch Reaktion von Zinn(IV)-oxidhydrat mit Bariumhydroxid bei 250 °C oder durch Reaktion von Bariumcarbonat mit Zinn(IV)-oxid bei 1200 bis 1400 °C gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Bariumcarbonat mit Zinn(IV)-chlorid oder Zinn(IV)-oxid mit Bariumnitrat.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumstannat und sein Trihydrat sind weiße Feststoffe, die schwer löslich in Wasser sind.[1] Er ist ein halbleitendes Oxid mit einer großen Bandlücke von mehr als 3,1 eV.[3] Er besitzt eine kubische Kristallstruktur mit der Raumgruppe Pm3m (Raumgruppen-Nr. 221).[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bariumstannat wird zur Herstellung von speziellen Keramikisolierungen, die dielektrischen Eigenschaften erfordern, eingesetzt.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 487 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Wensheng Lu, Helmut Schmidt: Hydrothermal synthesis of nanocrystalline BaSnO3 using a SnO2-xH2O sol. In: Journal of the European Ceramic Society. 25, 2005, S. 919, doi:10.1016/j.jeurceramsoc.2004.04.010.
- ↑ Ku Noor Dhaniah Ku Muhsen, Rozana Aina Maulat Osman, Mohd Sobri Idris: Giant anomalous dielectric behaviour of BaSnO3 at high temperature. In: Journal of Materials Science: Materials in Electronics. , doi:10.1007/s10854-019-01065-x.

