Benutzer:Tzaph/Litholrot
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Allgemeines | |||||||
| Name | Tzaph/Litholrot | ||||||
| Andere Namen |
| ||||||
| Summenformel | C20H14N2O4S (freie Säure) | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | |||||||
| Aggregatzustand |
roter Feststoff | ||||||
| Dichte |
1,42 g·cm−3 (Ca-Salz)[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
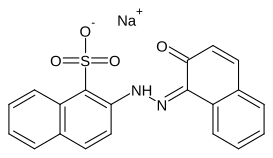
Litholrot R ist ein Azofarbstoff, der durch die Diazotierung von 1-Sulfonsäure-2-Naphthylamin und die anschließende Azokupplung des Diazonium-Ions mit 2-Naphthol synthetisiert wird und zählt zur Gruppe der Monoazo-Pigmente.
Das einfachste Rot-Pigment ist teilweise wasserlöslich und nicht sehr lichtbeständig.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Litholrot R wurde im Jahre 1899 von Paul Julius während seiner Anstellung bei der BASF entwickelt sowie zum Patent angemeldet und war das erste synthetisch hergestellt Handelsprodukt der Azofarbstoffe der BASF.[3] Die Entdeckung wurde der Ausgangspunkt für die systematische Erschließung der organischen Pigmente durch die BASF.[4]
In den 1950´ern war es das wichtigste Rotpigment in der Druckerindustrie und wurde hier in größeren Mengen, als jedes andere Rotpigment verwendet.[5] Nicht zuletzt seine günstige und unkomplizierte Herstellung sowie der hohe Glanz und die guten Verarbeitungseigenschaften führten zu dieser Vormachtstellung. In der heutigen Zeit hat seine Bedeutung zunehmend abgenommen. Es wird in den USA heutzutage immernoch deutlich häufiger verwendet, als in Europa.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur Synthese von Litholrot R wird die primäre aromatische Aminkomponente 1-Sulfonsäure-2-Naphthylamin mit salpetriger Säure diazotiert und dann auf 2-Naphthol gekuppelt, welches zuvor in leicht basischem Milieu in Lösung gebracht und / oder auf eine Faser aufgezogen wurde.

Vereinfachte Darstellung der Synthese des Litholrot-Natriumsalzes.
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]VIS-Spektroskopische Untersuchungen zeigten, dass die Litholrot-Salze in ihrer Hydrazon-Form vorliegen[6]. Sowohl die freie Säure, als auch die Salze zeigen eine hohe Lichtempfindlichkeit. So heißt es z. B. "Barium und Calcium-Litholrot, welches für eine Dauer von drei Monaten der Sonne in Florida ausgesetzt waren, sind komplett verblichen". Die Zugabe von Titandioxid beschleunigt diesen Bleaching-Effekt.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Letzendliche Verwendung finden jedoch, auf Grund der Löslichkeit der freien Säure, eher die aus dieser herstellbaren Salze durch sogenannte Verlackung:
- Na-Salz:
- Eher ein löslicher Farbstoff, als ein Pigment, welches auf Grund der guten Wasserlöslichkeit und somit eintretenden Blutung bei Wasserkontakt wenig verwendet wurde, fand primär Verwendung als Grundlage für Ionenaustauschreaktionen mit höherwertigen Kationen[8], um die folgenden Pigmente zu erhalten:
- Ba-Salz:
- Verwendung als wasserunlösliches Pigment für wasserbasierte Druckfarben
- Ca-Salz & Sr-Salz:
- Bei nicht-wasserbasierten Verwendungen hängt die Wahl der Salze für die Einfärbung primär von der jeweiligen Farbwirkung ab, die bei den unterschiedlichen Kationen jeweils differiert.
Hauptanwendung sind auch heutzutage immernoch Druckerfarben.
Früher fand es eine deutlich breitere Anwendung - so wurden die Lithol-Pigmente 1971 in den Colour-Index aufgenommen, der zur damaligen Zeit die folgenden Anwendungen nannte:
alkyd resin enamels and lacquers, linoleum, paper coating, emulsion paints, polyvinyl chloride, urea formaldehyde, phenol formaldehyde, polystyrene and amide-based plastics, and student grade artists’ materials[9]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Gemäß der ECHA-Datenbank gehen vom Na-Salz keine Gefahren aus und die Substanz trägt keine Gefahrstoffkennzeichnung. Zu den anderen Salzvarianten und der freien Säure liegen keine toxikologischen Daten vor.
Grundsätzlich besteht jedoch das Risiko des Vorhandenseins von Substanzresten aus dem Herstellprozess sowie Nebenprodukten mit toxikologisch bedenklichen Eigenschaften.
Nachweis
[Bearbeiten | Quelltext bearbeiten]Für die Untersuchung von Azo-Pigmenten, so auch für Litholrot[10], hat sich das Verfahren der Pyrolyse-Gaschromatographie mit gekoppelter Massenspektrometrie (PYGCMS) bewährt.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Alfa Chemistry: Pigment Red 49:2. Abgerufen am 3. April 2018 (englisch).
- ↑ Eintrag zu Sodium 2-[(2-hydroxynaphthyl)azo]naphthalenesulphonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Prof. Dr. Artur Goldschmidt, Dr. Hans-Joachim Streitberger: BASF-Handbuch - Lackiertechnik. Hrsg.: BASF Coatings AG. Vincentz Verlag, Hannover 2002, ISBN 3-87870-324-4, S. 153.
- ↑ C. H. Beck: Die BASF - Eine Unternehmensgeschichte. Hrsg.: Werner Abelshauser. 2. Auflage. C. H. Beck oHG, München 2003, ISBN 3-406-49526-5, S. 70.
- ↑ A.W.C. Harrison: The Manufacture of Lakes and Precipitated Pigments. Hrsg.: Leonard Hill Limited. London 1957, S. 232.
- ↑ Wojciech Czajkowski: Spectral studies of lithol red pigments. In: Dyes and Pigments. Band 8, Nr. 2, S. 141–150, doi:10.1016/0143-7208(87)85012-x (elsevier.com [abgerufen am 3. April 2018]).
- ↑ Vincent C. Vesce: Exposure Studies of Organic Pigments in Paint Systems - Joseph J. Mattiello Memorial Lecture. Hrsg.: Federation of Societies for Paint Technology. Allied Chemical, National Aniline Division, Atlantic City, New Jersey 1959.
- ↑ Harriet A. L. Standeven: The History and Manufacture of Lithol Red, a Pigment Used by Mark Rothko in his Seagram and Harvard Murals of the 1950s and 1960s. In: TATE (Hrsg.): Tate Papers. Nr. 10, 2008, ISSN 1753-9854.
- ↑ Society of Dyers and Colourists & AATCC (Hrsg.): Colour Index. 1971, S. 3307.
- ↑ Jens Stenger et. al.: Lithol red salts : characterization and deterioration. In: Morana RTD d.o.o. (Hrsg.): E-Preservation Science. Band 7, 1. Dezember 2010, ISSN 1581-9280, S. 147 - 157.
- ↑ Astrid Rehorek, Alexander Plum: Characterization of sulfonated azo dyes and aromatic amines by pyrolysis gas chromatography/mass spectrometry. In: Analytical and Bioanalytical Chemistry. Band 388, Nr. 8, 1. August 2007, ISSN 1618-2642, S. 1653–1662, doi:10.1007/s00216-007-1390-0 (springer.com [abgerufen am 3. April 2018]).