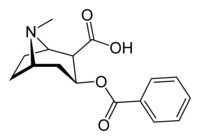
Benzoylecgonin
| Stoffwechselintermediat | |
|---|---|
| |
| Allgemeines | |
| Eigenschaften | |
| Summenformel | C16H19NO4 |
| Molare Masse | 289,331 g·mol−1 |
| Identifikatoren | |
| CAS-Nummer | |
| PubChem | |
| Wikidata | |
Benzoylecgonin ist der Hauptmetabolit von Kokain. Es wird in der Leber gebildet und über den Urin ausgeschieden. Bei den meisten Kokain-Drogentests und bei Abwasseruntersuchungen auf Kokainkonsum wird auf diese Verbindung getestet.
Biochemie und Physiologie
[Bearbeiten | Quelltext bearbeiten]Chemisch gesehen ist Benzoylecgonin der Benzoat-Ester von Ecgonin. Es ist ein primärer Metabolit von Kokain,[1] und pharmakologisch inaktiv.[2] Benzoylecgonin ist die korrespondierende Carbonsäure von Kokain, bzw. Kokain der Methylester von Benzoylecgonin. Die Verbindung entsteht in der Leber beim Abbau von Kokain durch Hydrolyse, katalysiert durch Carboxyl-Esterasen, und wird anschließend über den Urin ausgeschieden. Benzoylecgonin lässt sich leicht durch Kochen von Kokain in Form der freien Base in Wasser synthetisieren.[3]
Vorkommen im Trinkwasser
[Bearbeiten | Quelltext bearbeiten]Benzoylecgonin kommt manchmal im Trinkwasser vor. 2005 fanden Wissenschaftler im italienischen Fluss Po überraschend große Mengen Benzoylecgonin und schätzten anhand der Konzentration die Zahl der Kokainkonsumenten in der Region.[4] 2006 wurde im Schweizer Skiort St. Moritz eine ähnliche Studie durchgeführt. Dabei wurde anhand von Abwasser der tägliche Kokainkonsum der Bevölkerung geschätzt.[5] Eine im Vereinigten Königreich durchgeführte Studie fand Spuren von Benzoylecgonin im Trinkwasser des Landes, zusammen mit Carbamazepin (einem Antikonvulsivum) und Ibuprofen. Die Mengen der gefundenen Verbindungen waren mehrere Größenordnungen niedriger als die therapeutische Breite und stellten daher kein Risiko für die Bevölkerung dar.[6]
Vorstudien an ökologischen Systemen zeigen, dass Benzoylecgonin potenziell toxisch ist und in umweltrelevanten Konzentrationen negative ökologische Auswirkungen hat.[7] Deshalb werden Möglichkeiten erforscht, Benzoylecgonin durch erweiterte Oxidation und Photokatalyse in der Umwelt abzubauen,[8] um die Konzentrationen in Abwässern und Oberflächengewässern zu reduzieren.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Charles W Schindler, Steven R Goldberg: Accelerating Cocaine Metabolism as an Approach to the Treatment of Cocaine Abuse and Toxicity. In: Future Medicinal Chemistry. Band 4, Nr. 2, 2012, S. 163–175, doi:10.4155/fmc.11.181, PMID 22300096.
- ↑ Eric T. Shimomura, George F. Jackson, Buddha Dev Paul: Critical Issues in Alcohol and Drugs of Abuse Testing (Second Edition). Academic Press, 2019, ISBN 978-0-12-815607-0, Chapter 17 - Cocaine, Crack Cocaine, and Ethanol: A Deadly Mix, S. 215–224, doi:10.1016/b978-0-12-815607-0.00017-4.
- ↑ Stephen P. Findlay: The Three-dimensional Structure of the Cocaines. Part I. Cocaine and Pseudococaine. In: Journal of the American Chemical Society. Band 76, Nr. 11, 1954, S. 2855–2862, doi:10.1021/ja01640a001.
- ↑ Italian river 'full of cocaine'. In: BBC News. 5. August 2005, abgerufen am 1. Juli 2024.
- ↑ Tant de coke ? Stupéfiant! In: Courrier International. 1. Februar 2006, abgerufen am 1. Juli 2024 (französisch).
- ↑ Adam Withnall: Cocaine use in Britain so high it has contaminated our drinking water, report shows. In: The Independent. 11. Mai 2014, abgerufen am 1. Juli 2024.
- ↑ A. Binelli, I. Marisa, M. Fedorova, R. Hoffmann, C. Riva: First evidence of protein profile alteration due to the main cocaine metabolite (benzoylecgonine) in a freshwater biological model. In: Aquatic Toxicology. Band 140-141, 2013, S. 268–278, doi:10.1016/j.aquatox.2013.06.013, PMID 23838174.
- ↑ Cristina Postigo, Carla Sirtori, Isabel Oller, Sixto Malato, Manuel Ignacio Maldonado, Miren López de Alda, Damià Barceló: Solar transformation and photocatalytic treatment of cocaine in water: Kinetics, characterization of major intermediate products and toxicity evaluation. In: Applied Catalysis B: Environmental. Band 104, Nr. 1-2, 2011, S. 37–48, doi:10.1016/j.apcatb.2011.02.030.