Bisindolylmaleimid 4
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
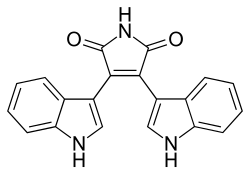
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bisindolylmaleimid 4 | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C20H13N3O2 | |||||||||
| Kurzbeschreibung |
roter Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 327,34 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bisindolylmaleimid 4 ist eine chemische Verbindung aus der Gruppe der Bisindolylmaleimide und deren Grundverbindung.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Bisindolylmaleimid 4 kommt natürlich in Myxomyceten (Schleimpilzen) Arcyria major beziehungsweise Arcyria denudata vor. Myxomyceten produzieren eine Reihe weiterer Bisindolylderivate.[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bisindolylmaleimid 4 kann durch Reaktion von Dichlormaleimid oder Dibrommaleimid mit Indolylmagnesiumbromid gewonnen werden.[4][5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bisindolylmaleimid 4 ist ein roter Feststoff, der löslich in DMSO ist.[2][1] Es ist ein Proteinkinase-C-Hemmer.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bisindolylmaleimid 4 kann zur Herstellung anderer chemischer Verbindungen (zum Beispiel Staurosporiron) verwendet werden.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Burkhard Fugmann: RÖMPP Lexikon Naturstoffe, 1. Auflage, 1997. Georg Thieme Verlag, 2014, ISBN 3-13-179541-7, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Datenblatt Bisindolylmaleimide IV, ≥98% (TLC), solid bei Sigma-Aldrich, abgerufen am 14. Juli 2017 (PDF).
- ↑ Steglich, W. (1989): Slime moulds (Myxomycetes) as a source of new biologically active metabolites. In: Pure Appl. Chem., 61(3); 281–288; doi:10.1351/pac198961030281; PDF (freier Volltext, engl.)
- ↑ a b Krishna C. Majumdar, Shital K. Chattopadhyay: Heterocycles in Natural Product Synthesis. John Wiley & Sons, 2011, ISBN 3-527-63489-4, S. 119 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Chemistry and Pharmacology. Academic Press, 1995, ISBN 978-0-08-086571-3, S. 203 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ John Buckingham, Keith H. Baggaley, Andrew D. Roberts, Laszlo F. Szabo: Dictionary of Alkaloids, Second Edition with CD-ROM. CRC Press, 2010, ISBN 978-1-4200-7770-4, S. 216 (eingeschränkte Vorschau in der Google-Buchsuche).