Impfung

Eine Impfung, auch Schutzimpfung, Vakzination (älter Vaccination) oder Vakzinierung (ursprünglich die Infektion mit Kuhpockenmaterial; von lateinisch vacca ‚Kuh‘) genannt, ist die Gabe eines Impfstoffes mit dem Ziel, vor einer (übertragbaren) Krankheit zu schützen.[1] Sie dient der Aktivierung des Immunsystems gegen spezifische Stoffe. Impfungen wurden als vorbeugende Maßnahme gegen Infektionskrankheiten entwickelt. Später wurden für Krebsimmuntherapien auch Krebsimpfstoffe entwickelt.
Eine vorbeugende Impfung gegen eine Infektionskrankheit beruht auf einer spezifischen, aktiven Immunisierung gegen den Krankheitserreger und wird daher auch als aktive Impfung oder aktive Schutzimpfung bezeichnet. Ziel der aktiven Impfung ist es, das körpereigene Immunsystem zu befähigen, auf eine Infektion mit dem Erreger so rasch und wirksam zu reagieren, dass daraus keine oder nur eine abgeschwächte Infektionskrankheit resultiert. Es wird zwischen Lebendimpfstoffen und Totimpfstoffen unterschieden; zu letzteren gehören auch Toxoidimpfstoffe. Dagegen handelt es sich bei der passiven Impfung (auch Heilimpfung) um eine lediglich passive Immunisierung durch Gabe von Antikörpern.
Es stehen bereits Impfungen gegen eine Vielzahl von viralen und bakteriellen Infektionskrankheiten zur Verfügung. Weitere Impfstoffe gegen einige bedeutsame Infektionskrankheiten und gegen chronische Infektionen, die Krebs begünstigen, sind derzeit (Stand 2012) in Entwicklung.
Wirkungsweise und Wirksamkeit
Verabreichung von Impfungen
Je nach Impfstoff und Immunisierungsart (passive oder aktive Immunisierung) werden unterschiedliche Applikationsverfahren angewandt: Aktive Impfungen werden parenteral („unter Umgehung des Magen-Darm-Traktes“) mit einer Spritze vorgenommen. Man unterscheidet dabei intradermale („in die Haut“), subkutane („unter die Haut“) oder intramuskuläre („in den Muskel“) Injektionen. Die intradermale Impfung kann auch mit einer Lanzette oder einer Impfpistole erfolgen. Für einige wenige Immunisierungen wurde bzw. wird der Impfstoff oral (in den Mund, „Schluckimpfung“) oder nasal (in die Nase) verabreicht, versuchsweise auch mit Hautpflaster. Die meisten aktiven Impfungen werden jedoch intramuskulär in den Oberarm (Musculus deltoideus) verabreicht. Bei Kindern ist auch eine Injektion in den Oberschenkel (Musculus vastus lateralis) zulässig; bei kleinen Kindern kommt es nach bestimmten Impfungen zu weniger Lokalreaktionen, wenn diese in den Oberschenkel erfolgen.[2] Die Injektion von aktiven Impfstoffen in den mittleren Gesäßmuskel (Musculus glutaeus medius) gilt aufgrund geringerer Wirksamkeit und häufigerer Komplikationen laut der Ständigen Impfkommission (STIKO) als obsolet.
Passive Immunisierungen hingegen werden häufig in den Gesäßmuskel verabreicht.
Die Pulverinjektion ist ein in der Entwicklung befindliches Impfverfahren, bei dem der feste Impfstoff mit hoher Geschwindigkeit in die Epidermis geschossen wird.
Aktive Impfung

Die aktive Schutzimpfung veranlasst den Körper des Geimpften, eigene Schutzstoffe gegen bestimmte Krankheiten herzustellen. Sein Immunsystem wird zur Bildung einer erregerspezifischen Immunkompetenz angeregt, ohne die Infektionskrankheit selbst durchmachen zu müssen. Hierzu dienen Lebend- oder Totimpfstoffe. Ein Lebendimpfstoff enthält abgeschwächte, noch vermehrungsfähige Erreger, welche die Krankheit beim immunkompetenten Impfling nicht auslösen. Ein Totimpfstoff enthält dagegen abgetötete Erreger oder lediglich Bruchstücke des Erregers. Gegen das Coronavirus SARS-CoV-2 wurden 2020 erstmals RNA-Impfstoffe zugelassen.[3]
Ist der Impfstoff in den Körper eingedrungen, werden die Eiweiße (Proteine) und/oder Zuckermoleküle des Vakzins durch im Blut zirkulierende und/oder gewebsständige immunkompetente weiße Blutzellen als (körperfremde) Antigene erkannt. Es folgt die primäre Immunantwort durch erregerspezifische Prägung immunkompetenter Lymphozyten in Form langlebiger Gedächtniszellen. Entscheidend für den Schutz bei einer späteren Infektion ist, dass für den Körper die Antigene des Impfstoffs denen des Erregers der Infektionskrankheit weitgehend gleichen.
Kommt es zur Infektion, erkennen die Gedächtniszellen am eingedrungenen Erreger die Antigene des früher erhaltenen Impfstoffes und bewirken, dass sich einerseits Lymphozyten zu kurzlebigen Plasmazellen differenzieren, die Antikörper produzieren, andererseits zu T-Lymphozyten und NK-Zellen, welche die zelluläre Abwehr darstellen.[4] Die Impfung soll also Immunität gegen den Erreger bewirken, sodass im Falle einer Infektion die spezifische und schnelle Immunantwort die Infektionskrankheit verhindert.
Toxoidimpfstoffe, die nur den biologisch inaktiven Bestandteil (Toxoid) des Toxins eines Erregers enthalten (z. B. das Tetanus-Toxoid), gehören ebenfalls zu den Totimpfstoffen. Sie vermindern nicht die Vermehrung der Erreger im Körper. Bei Infektionen, die übertragbar sind, unterbrechen sie also nicht die Infektionskette, verhindern aber die Infektionskrankheit bei den Geimpften, insoweit bei ihnen die Toxine der Erreger nicht wirksam werden.
Unterschiedliche Lebendimpfstoffe können entweder simultan oder im Abstand von mindestens vier Wochen verabreicht werden.[5] Für Totimpfstoffe unter sich oder in Kombination mit Lebendimpfstoffen gibt es keine notwendigen Abstände. Dennoch wird eine parallele Gabe von Tot- und Lebendimpfstoffen bevorzugt.[6]
Ein tragfähiger Schutz baut sich bei Lebendimpfstoffen nach wenigen Tagen auf.[7] Bei Totimpfstoffen müssen wiederholte Immunisierungen erfolgen (Basisschutz), gefolgt von Auffrischungsimpfungen.
Eine Therapieform, die dem Prinzip einer aktiven Immunisierung ähnelt, aber die keine Impfung darstellt, ist die Hyposensibilisierung. Sie wird beispielsweise bei Heuschnupfen oder Allergien gegen Hausstaubmilben und Insekten angewendet.[8]
Passive Impfung
Bei der passiven Impfung, auch (Blut-)Serumtherapie und Serotherapie genannt, wird dem Empfänger Immunserum injiziert, das in hoher Konzentration Antikörper gegen den Krankheitserreger enthält. Dadurch stellt das eigene Immunsystem also selbst keine Antikörper her, bleibt also passiv. Hierzu verwendet man heute bevorzugt gentechnologisch aus Zellkulturen hergestellte monoklonale menschliche Antikörper bzw. homologe Antikörper oder, soweit solche nicht zur Verfügung stehen, Extrakte aus dem Blut (Rekonvaleszentenserum) von Menschen, die die betreffende Infektionskrankheit (ungewollt) durchgemacht haben, oder aus dem Blut von Tieren bzw. heterologe (artfremde) Antikörper, die gezielt mit dem Erreger infiziert worden waren. Die passive Immunisierung ist also eine Notfallmaßnahme („Notimpfung“) im Sinne einer Postexpositionsprophylaxe. Beispielhaft hierfür sind Verletzungen mit Verschmutzung der Wunde (Verdacht auf eine Infektion mit Wundstarrkrampf), Bisse durch oder Schleimhautkontakt mit bestimmten Wildtieren (Verdacht auf Tollwut) oder der Kontakt von medizinischem Personal mit Blut von Patienten, die Träger der Erreger von Hepatitis B sind (insbesondere nach Nadelstichverletzung). Eine passive Impfung ist indiziert, wenn eine Person in Gefahr steht, eine Infektionskrankheit zu erleiden, weil sie Kontakt mit dem betreffenden Erreger hatte, ohne bereits durch stille Feiung oder Impfung hiergegen geschützt zu sein, oder wenn der Schutz durch das eigene Immunsystem ergänzt werden soll.
Der Vorteil von Immunseren ist der schneller einsetzende Schutz: Die Antikörper müssen nicht erst innerhalb von ein bis zwei Wochen gebildet werden, sondern stehen gleich nach der Injektion des Immunserums zur Verfügung. Nachteilig ist, dass der Schutz nur einige Wochen anhält; danach sind die verabreichten Antikörper vom Empfänger abgebaut, und sein Organismus ist durch eine neuerliche Infektion mit demselben Erreger wieder gefährdet. Das liegt daran, dass das Immunsystem durch die Gabe von Immunserum nicht stimuliert wird, über Gedächtniszellen ein eigenes Immungedächtnis hinsichtlich der Erreger auszubilden.
Falls das Immunserum von einem Tier oder Menschen stammt, kommt als weiterer Nachteil hinzu, dass es neben den gewünschten Antikörpern Spuren von Fremdeiweiß oder Polysacchariden des Spenders enthalten kann. Das Immunsystem des Empfängers setzt dann eine Kaskade immunologischer Reaktionen gegen diese als körperfremde Antigene empfundenen Bestandteile in Gang. Das führt dazu, dass die im Impfserum angereicherten Antikörper schneller ausgeschieden werden und damit kürzer als gewünscht wirksam bleiben. Bei wiederholter Gabe von Fremdserum besonders derselben Tierart kann es außerdem zu einer unerwünschten allergischen Reaktion des Empfängers in Form einer Serumkrankheit oder eines allergischen Schocks kommen. Daher werden solche Immunseren nach Möglichkeit durch monoklonale Antikörper ersetzt.
Bis circa 1965 gab es beispielsweise keine menschlichen Antikörper gegen Tetanus, sodass man auf tierische angewiesen war. Hierbei hatte sich die Reihenfolge Pferd, Rind, Hammel etabliert.[9]
Eingeführt wurde die passive Immunisierung 1890 von Emil von Behring, als er ein Heilverfahren gegen Diphtherie entwickelte, bei dem er aus Pferdeblut isolierte Antikörper verwendete. Er erhielt dafür 1901 den erstmals vergebenen Nobelpreis für Medizin. Im Jahr 1904 wurde zur Anwendung bei der bazillären Dysenterie die Serotherapie nach Rudolf Kraus und Robert Doerr[10] etabliert.
Eine wichtige und weit verbreitete natürliche Form der passiven Immunisierung gegen Infektionskrankheiten ist die Mutter-Kind-Immunisierung.
Zu den passiven Immunisierungen, die sich nicht gegen Infektionskrankheiten richten, gehören die Injektion von Anti-D-Immunserum an Schwangere, falls beim Neugeborenen ein Morbus haemolyticus neonatorum droht, und die Injektion von Antivenin nach Schlangenbissen.
Simultanimpfung
Wenn ein Patient mit möglicherweise oder bekannt unzureichendem Immunschutz im Verdacht steht, sich mit Erregern einer gefährlichen Infektionskrankheit infiziert zu haben, wird er neben der aktiven Schutzimpfung eine passive Immunisierung erhalten, um einer lebensbedrohlichen Infektion vorzubeugen. Eine solche gleichzeitige aktive und passive Immunisierung eines Patienten wird als Simultanimpfung bezeichnet. Hierbei spritzt man den aktiven und den passiven Impfstoff in möglichst entfernte Körperstellen, damit sich die Antikörper der Heilimpfung und die Antigene der Schutzimpfung nicht sofort wechselseitig neutralisieren.
Mutter-Kind-Immunisierung
Eine vorübergehende Form der passiven Immunisierung stellt die Mutter-Kind-Immunisierung dar, auch Nestschutz oder Leihimmunität genannt. Hierbei geben Schwangere, die nach Infektionen oder Impfungen einen entsprechenden Antikörpertiter entwickelt haben, Antikörper über die Placenta an das Ungeborene weiter. Dieses ist nach der Geburt für einige Wochen bis Monate in gewissem Umfang geschützt.
Stillende Mütter versorgen den Säugling mit sekretorischen Antikörpern (sIgA), die zwar das Risiko für Magen-Darm-Erkrankungen senken.[11] Sie vermitteln aber nicht einen Schutz gegen impfpräventablen Erkrankungen wie z. B. Masern.[12]
Der Nestschutz wird aber nicht für alle Infektionskrankheiten vermittelt. Die allgemein und in Deutschland insbesondere durch die Ständige Impfkommission empfohlenen Kinder-Impfungen sollen daher so frühzeitig erfolgen, dass keine Lücke in der Erreger-Abwehr entsteht.[13]
Wirksamkeit
| Erkrankung | vorher (Jahr) |
nachher (Jahr) |
|---|---|---|
| Diphtherie | 175.885 (1922) |
1 (1998) |
| Haemophilus Influenzae B | 20.000 (1982) |
54 (1998) |
| Keuchhusten | 147.271 (1925) |
6.279 (1998) |
| Masern | 503.282 (1962) |
89 (1998) |
| Mumps | 152.209 (1968) |
606 (1998) |
| Pocken | 48.164 (1904) |
0 (1998) |
| Röteln | 47.745 (1968) |
345 (1998) |
Keine Impfung schützt hundertprozentig vor der jeweiligen Erkrankung. Impfungen senken aber die Erkrankungswahrscheinlichkeit deutlich. Die Schutzwirkung unterscheidet sich je nach Impfung und nach der Stärke der Immunantwort. Die Impfstoffwirksamkeit wird durch viele Studien dokumentiert und zum Beispiel in Europa von der EMA (European Medicines Agency bzw. Europäische Arzneimittel-Agentur) werden Impfstoffe nach einer Nutzen/Risiko-Abwägung zugelassen, nachfolgend von nationalen Behörden empfohlen oder verpflichtend gegeben.[15][16]
Die jeweilige Schutzwirkung lässt sich laborchemisch mit der Messung der gegen den Erreger oder dessen Bestandteile gebildeten Antikörperkonzentration, den Antikörpertiter, abschätzen. Entscheidend ist die Wirksamkeit im Rahmen von klinischen Studien, nach Möglichkeit in Form randomisierter kontrollierter Studien. Hierbei werden die Studienteilnehmer zufällig in zwei Gruppen eingeteilt. Man vergleicht dabei entweder bestimmte Laborwerte (Surrogatmarker, vor allem Antikörper) oder die Häufigkeit und Schwere der Infektionskrankheit in der Studiengruppe, also bei Menschen oder Tieren, die den zu beurteilenden Impfstoff erhalten haben, mit derjenigen in der Kontrollgruppe, also bei Menschen oder Tieren, die keinen oder einen bereits bekannten Impfstoff erhalten haben. Wirksamkeitsnachweise, bei denen Menschen gezielt mit Erregern schwerwiegender Infektionskrankheiten infiziert werden, verbieten sich aus ethischen Gründen, da hierbei Kontrollgruppe und Studiengruppe einem unvertretbaren Risiko ausgesetzt würden. Die Zulassung von Impfstoffen erfolgt in Europa nach den Richtlinien der Europäischen Arzneimittelagentur und der entsprechenden staatlichen Behörden. Sie setzt präklinische und klinische Prüfungen voraus und verlangt weitere Kontrollen nach Markteinführung. In Deutschland prüft und überwacht das Paul-Ehrlich-Institut die Zulassung von Impfstoffen. Kriterien und Vorgehen sind in anderen entwickelten Staaten wie etwa den USA und Kanada ähnlich.
Es gibt Impfungen, die bisher lediglich den Krankheitsverlauf abmildern und somit nur vor den schlimmsten Komplikationen schützen. Das ist vor allem dann der Fall, wenn die betreffenden Erreger ihre Eigenschaften durch Antigenshift oder Antigendrift häufig ändern, wie bei den Erregern von Influenza, und wenn die Erreger in zahlreichen Antigen-Subtypen zirkulieren, wie bei den Pneumokokken. Staatliche Stellen bewerten die Impfstoffe hinsichtlich ihres Nutzens und sprechen anschließend eine amtliche Empfehlung aus.[17] Die Empfehlungen haben kassen-, haftungs- und arztrechtliche Folgen.
Moderne Impfstoffe gegen Tetanus, Hepatitis, Meningokokken, Pneumokokken und Gebärmutterhalskrebs enthalten als Wirkungsverstärker aluminiumhaltige Adjuvanzien wie z. B. Aluminiumhydroxid, um die Anzahl der notwendigen Impfzyklen zu senken.
Seit Einführung der Impfungen in den USA sank die Zahl der jährlichen Erkrankungen von Diphtherie, Mumps, Keuchhusten und Tetanus um mehr als 92 %, während die Zahl der an diesen Krankheiten Verstorbenen um mindestens 99 % zurückging. Poliovirus, Masern sowie das Rötelnvirus gelten in den Vereinigten Staaten als ausgerottet, 1980 konnte die Welt von der Weltgesundheitsorganisation (WHO) für pockenfrei erklärt werden.[18]
Umgekehrt starben weltweit nach Schätzung der WHO und der Global Alliance for Vaccines and Immunization (GAVI) allein im Jahr 2002 über zwei Millionen Menschen an Infektionskrankheiten, die durch eine Impfung hätten verhindert werden können. Durch Impfprogramme diese Todesursachen zu verringern ist daher ein primäres Ziel der WHO. Die Erfolge dieser Impfprogramme belegen die Wirksamkeit des Impfens. Die meisten verfügbaren Impfstoffe sind im Abschnitt Empfohlene Impfungen aufgelistet.
Abschwächung der Wirksamkeit durch Wechselwirkung mit Schmerzmitteln
Impfstoffe sind Arzneimittel, und bei gleichzeitigem Einwirken mehrerer Arzneimittel können Arzneimittelwechselwirkungen auftreten. Sie können bestehen in einer Steigerung oder Senkung der Wirksamkeit, im Verstärken oder Vermindern bekannter oder im Auftreten neuer Nebenwirkungen. In letzter Zeit mehren sich die Hinweise, dass bestimmte Medikamente aus der Gruppe der nichtsteroidalen Antirheumatika (NSAR) bzw. nichtsteroidalen Antiphlogistika wie Acetylsalicylsäure (Aspirin), aber auch andere Nichtopioid-Analgetika wie Paracetamol und davon abgeleitete Substanzen die Wirksamkeit von Impfstoffen herabsetzen können.[19][20][21][22] Das wird darauf zurückgeführt, dass diese Pharmaka ihre fiebersenkende und (bei den NSAR) auch entzündungsmindernde Wirkung dadurch erzielen, dass sie hemmend auf bestimmte Enzyme, die Cyclooxygenasen (COX), einwirken, weshalb sie auch Cyclooxygenasehemmer genannt werden. Die an der Prostaglandinsynthese beteiligten COX spielen aber eine wichtige Rolle auch bei der Immunabwehr. Das Blockieren des Enzyms hat offenbar die Nebenwirkung, die Produktion schützender Antikörper nach einer Impfung zu verringern, da die terminale Differenzierung der B-Zellen zu antikörperproduzierenden Plasmazellen beeinträchtigt wird.[23][24] Daher wird empfohlen, einige Zeit vor und nach der Impfung auf COX-hemmende Medikamente zu verzichten.[25][26][27]
Auffrischungsimpfung
Die Auffrischungsimpfung, auch als Auffrischimpfung, Wiederholungsimpfung oder Revakzination, auch als Boosterimpfung oder nur Booster bezeichnet, unterscheidet sich von der Grundimmunisierung dadurch, dass einmalig eine geringe Dosis gegeben wird, wodurch binnen etwa einer Woche wieder eine ausreichende Immunisierung des Patienten gegen eine bestimmte Infektionskrankheit erzielt wird. Nach der Grundimmunisierung sind für die dauerhafte Immunität gegen die meisten Krankheitserreger Auffrischungsimpfungen nach unterschiedlich langen Abständen notwendig. Die Abstände zwischen den Auffrischungsimpfungen basieren auf Anwendungsbeobachtungen und hängen sowohl vom Erreger als auch vom Impfstoff ab. Manche Impfungen können sogar ohne Auffrischungsimpfung einen lebenslangen Schutz vermitteln.
Beispielsweise konnte bei Pockenimpfungen eine Pockenimmunität noch bis zu 88 Jahre nach der Impfung nachgewiesen werden, die vergleichbar war mit der Immunisierung nach einer überstandenen Erkrankung.[28] Nach Impfungen gegen Masern, Mumps und Röteln fanden sich zum größten Teil 20 Jahre später ausreichend hohe Antikörpertiter.[29] Ähnliches gilt für Impfungen gegen Hepatitis A. Andere Impfstoffe, wie beispielsweise der Impfstoff gegen Keuchhusten oder Diphtherie, benötigen nach aktueller Empfehlung alle zehn Jahre eine Auffrischungsimpfung, da der Antikörperspiegel nach 4–12 Jahren nachlässt; eine natürliche erworbene Immunität nach einer Keuchhusten-Erkrankung lässt nach 4–20 Jahren nach.[30] Dagegen muss die Impfung gegen Influenza mit den bisherigen Impfstoffen jährlich wiederholt werden.
- Auffrischungsimpfung und zusätzliche Impfstoffdosen für Grundimmunisierte
Nicht verwechselt werden sollte eine Auffrischungsimpfung mit der Verabreichung zusätzlicher Impfstoffdosen die zum Abschluss einer Grundimmunisierung notwendig wurden. Diese Teilimpfungen kommen im Rahmen der Grundimmunisierung z. B. im „2+1“-Schema oder „3+1“-Schema zum Tragen. Beim 3+1-Schema finden dreimal im Abstand von vier Wochen die notwendigen Teilimpfungen zur Grundimmunisierung statt. Beim 2+1-Schema beträgt der Abstand zwischen den beiden Teilimpfungen zur Grundimmunisierungen acht Wochen. Sechs Monate nach der Grundimmunisierung schließt das „2+1“-Schema ebenso wie das „3+1“-Schema regulär mit einer Auffrischimpfung ab.[31]
Bei der COVID-19-Impfung in Deutschland wurde das Schema der Auffrischungsimpfungen zur COVID-19-Prävention noch während der Pandemie optimiert. Zunächst wurden Impfserien mit den im EU/EWR dafür zugelassenen COVID-19-Impfstoffen[32] nach dem „2+1“-Schema verabreicht. Die Auffrischungsimpfung wurde zunächst im Abstand von sechs Monaten nach der Grundimmunisierung gegen COVID-19 verabreicht.[33] Am 21. Dezember 2021 änderte die Ständige Impfkommission beim RKI (STIKO) ihre COVID-19-Impfempfehlung. Allen gegen COVID-19 grundimmunisierten Personen, denen bisher eine Auffrischungsimpfung mit einem Abstand von sechs Monaten nahegelegt wurde, wird ab 21. Dezember 2021 ein verkürzter Abstand zur Grundimmunisierung von mindestens drei Monaten empfohlen.[34]
Die US-Behörde CDC hat am 3. Januar 2022 Auffrischungsimpfungen gegen COVID-19 für 12- bis 15-Jährige zugelassen.[35]
Nebenwirkungen
Die Nebenwirkungen der heute amtlich empfohlenen Impfungen sind in der Regel so gering, dass sie nicht oder als nicht wesentlich wahrgenommen werden. Unterschieden wird dabei zwischen Impfreaktion und Impfkomplikation. Dabei bezeichnet die Impfstoff-Reaktogenität das Ausmaß und die klinische Bedeutsamkeit der zu erwartenden Impfreaktion.
Bei der Bewertung von Reaktionen nach einer Impfung muss stets bedacht werden, dass Impfungen bei gesunden Menschen durchgeführt werden und eine anschließende Erkrankung als stark empfunden wird. Die Erwartung schwerer Nebenwirkungen kann zu einer gesteigerten Selbstbeobachtung führen (Nocebo-Effekt). Als Folge können zufällig auftretende Befindlichkeitsstörungen, die normalerweise gar nicht beachtet würden, plötzlich bewusst wahrgenommen und irrtümlich der Impfung angelastet werden.
Als sogenannte Impfreaktion werden kurzzeitig und vorübergehende Lokal- und Allgemeinreaktionen bezeichnet. Diese können als temporäre, leichtere Nebenwirkungen wie Schmerzen, Spannung und Schwellung an der Injektionsstelle, Abgeschlagenheit oder Kopf- und Gliederschmerzen auftreten.[36] In Doppelblind-Versuchen ohne Einwirkung von Erregern, bei denen die eine Hälfte der Freiwilligen den Impfstoff, die andere Hälfte eine Kochsalzlösung oder ein Aluminiumhydroxid-haltiges Adjuvans injiziert bekommt, berichten beide Gruppen bei den meisten amtlich empfohlenen Impfstoffen über quantitativ und qualitativ ähnliche Nebenwirkungen: z. B. Schwindel, Kopfschmerzen, Schwächegefühl, Muskelschmerzen.
| Symptom/Erkrankung | Komplikationsrate bei Erkrankung |
Komplikationsrate nach Impfung |
|---|---|---|
| Masern | MMR | |
| Exanthem | 98 % | 5 %, abgeschwächt |
| Fieber | 98 %, meist hoch | 3 bis 5 %, sehr selten hoch |
| Fieberkrämpfe | 7 bis 8 % | ≤ 1 % |
| Verminderung der Thrombozytenzahl | 1/3000 | 1/30.000 bis 1/50.000 |
| Enzephalitis | 1/1000 bis 1/10.000 | 0[38] |
| Letalität | 1/1000 bis 1/20.000 | 0 |
| Mumps | MMR | |
| Entzündung der Speicheldrüse | 98 % | 0,5 % |
| Pankreatitis | 2 bis 5 % | 0,5 % |
| Hodenentzündung bei Jugendlichen und erwachsenen Männern |
20 bis 50 % | 1/1.000.000 |
| Meningitis | ~ 15 % | 1/1.000.000 |
| Taubheit | 1/20.000 | 0 |
| Röteln | MMR | |
| Gelenkbeschwerden bei Frauen |
40 bis 70 %, anhaltend | 1/10.000, meist kurz und schwach |
| Enzephalitis | 1/6000 | 0 |
| Verminderung der Thrombozytenzahl | 1/3000 | 1/30.000 bis 1/50.000 |
| Rötelnembryofetopathie bei Infektion in der Schwangerschaft |
> 60 % | 0 |
Eine Impfkomplikation ist eine über das übliche Ausmaß einer Impfreaktion hinausgehende Komplikation nach einer Impfung. Lebendimpfstoffe können in seltenen Fällen zu einem Ausbruch derjenigen Krankheit führen, gegen die geimpft wurde. Zum Beispiel treten bei fünf Prozent der Geimpften gegen Masern nichtinfektiöse sogenannte „Impfmasern“ auf, die nach 1–3 Tagen wieder abklingen.[39] Die Nebenwirkungen der Impfung beinhalten dann die Symptome der Krankheit, beispielsweise leichten Ausschlag oder Fieber; sie verlaufen in der Regel aber leichter als die „natürliche“ Infektion. In sehr seltenen Fällen kann es zu einem allergisch-anaphylaktischen Schock als Reaktion auf die Inhaltsstoffe einer Impfdosis kommen.[40] Dies wurde in 33 Fällen (häufig mit Vorerkrankungen wie Atopien oder Asthma) bei 25,2 Millionen verabreichten Impfdosen beobachtet, keiner der Fälle verlief tödlich.[40]
Neben dem Wirkstoff selber können enthaltene Zusatzstoffe (siehe auch: Impfstoff#Zusammensetzung) wie z. B. Aluminiumverbindungen, Quecksilberverbindungen (Thiomersal), Formaldehyd und Antibiotika oder Stoffe aus der Herstellung des Wirkstoffs wie Hühnereiweiß eine solche Reaktion auslösen. Über dieses Risiko, ebenso wie über das Risiko der Impfung, müssen die Ärzte vor der Impfung ausreichend aufklären. Wer impft, muss durch Übung und geeignete Ausrüstung darauf vorbereitet sein, mögliche lebensbedrohliche allergische Reaktionen auf eine Impfung zu behandeln.
Bei Impfstoffen sind keine Langzeit-Nebenwirkungen oder Langzeitschäden (Schäden, die erst nach Jahren auftreten) bekannt.[41] Dies liegt daran, dass die Bestandteile einer Impfung im Körper schnell abgebaut werden. Infolgedessen werden die meisten Nebenwirkungen hauptsächlich innerhalb von Stunden oder Tagen beobachtet. Mit Langzeitfolgen sind sehr seltene Nebenwirkungen gemeint, die man statistisch erst nach vielen Jahren erfassen kann.[41]
Seit dem 1. Januar 2001 gilt für Ärzte in Deutschland die im Infektionsschutzgesetz (IfSG) verankerte „Meldeverpflichtung eines Verdachtes einer über das übliche Ausmaß einer Impfreaktion hinausgehenden gesundheitlichen Schädigung“ (Impfschaden im Sinne des § 2 Nr. 11 IfSG).[42] Nach § 6 Abs. 1, Nr. 3. IfSG besteht eine Meldepflicht für Ärzte an das Gesundheitsamt, wenn nach einer Impfung auftretende Symptome, die über eine Impfreaktion hinausgehen, in einem ursächlichen Zusammenhang mit der Impfung stehen könnten. Dieses Meldesystem ist ein sogenanntes Spontanerfassungssystem, um frühzeitig Risikosignale von Impfnebenwirkungen zu erkennen, die bei der Zulassung nicht erfasst wurden. Bis zum 31. Dezember 2003 wurden in allen Altersgruppen 3328 Fälle von möglichen Impffolgen registriert (in drei Jahren, bei etwa 30 Millionen Impfdosen/Jahr). Von diesen Betroffenen trugen vier Prozent einen bleibenden Schaden davon und 1,6 % verstarben (hauptsächlich belegte Koinzidenzen). In der Mehrzahl der dem Paul-Ehrlich-Institut (PEI) gemeldeten Verdachtsfälle wurde der Kausalzusammenhang zwischen Impfung und Erkrankung als unwahrscheinlich bewertet. In den anderen Fällen war der kausale Zusammenhang mit der Impfung wegen fehlender valider wissenschaftlicher Daten nicht beurteilbar. Ein Zusammenhang zwischen Impfung und Reaktion gilt nur bei 0,2 % aller IfSG-Meldungen als gesichert. In Deutschland besteht ein Anspruch auf Leistungen der Versorgungsämter, wenn eine Gesundheitsstörung möglicherweise auf eine öffentlich empfohlene Impfung zurückzuführen ist. Der Patient braucht jedoch nicht zu beweisen, dass die Impfung ursächlich für seine Krankheit war.[43]
Im Vergleich der Zahlen der möglichen Impfreaktionen mit den erfolgten Impfungen im selben Zeitraum ergibt sich ein sehr geringes Risiko, beispielsweise 250 IfSG-Meldungen zu möglichen Reaktionen von etwa sechs bis acht Millionen Impfdosen auf den MMR-Impfstoff im selben Zeitraum.[44] Die Rate der Meldungen hängt jedoch trotz der gesetzlichen Meldepflicht von der Motivation und Fähigkeit der Ärzte ab. Daher ist die Spontanerfassung allein nicht geeignet, die Häufigkeit von Impfnebenwirkungen abzuschätzen. Hierfür dienen aktiv erfassende Pharmakovigilanzsysteme und auf die jeweilige Impfkomplikation ausgerichtete Studien.
Allgemein verfügen Impfungen über ein exzellentes Sicherheitsprofil.[45]
„Falsche“ Gegenanzeigen
Häufig unterbleiben indizierte Impfungen (oder werden auf unbestimmte Zeit verschoben und schließlich vergessen), weil bestimmte Umstände irrtümlich als Impfhindernis angesehen werden. Nach Angaben des Robert Koch-Instituts[46]:319–320 sind dies insbesondere:
- banale Infekte, auch wenn sie mit leichtem Fieber einhergehen (bis 38,5 °C),
- Fieberkrämpfe in der Patienten-Vorgeschichte,
- Antibiotika-Einnahme,
- Immunschwäche (Ausnahme sind bestimmte Lebendimpfstoffe; allgemein gilt jedoch, dass gerade immungeschwächte Personen auf den Impfschutz besonders angewiesen sind) und
- chronische Krankheiten (einschließlich neurologische Erkrankungen), sofern keine spezifischen Kontraindikationen vorliegen.[47] Diese Personen sind wegen schwerer Verläufe und Komplikationen impfpräventabler Krankheiten besonders gefährdet.
Ökonomische Ersparnisse
Das Kosten-Nutzen-Verhältnis von Impfungen wurde anhand von Modellrechnungen ermittelt. So hat eine Berechnung in Österreich von 2003 ergeben, dass jede Masernschutzimpfung eine volkswirtschaftliche Ersparnis von ca. 600 Euro aufgrund der dadurch vermiedenen Masernerkrankung ergibt.[48] Hierbei wurden die Kosten einer Behandlung der mit einer Maserninfektion einhergehenden Nebenwirkungen berücksichtigt.
Der beträchtliche ökonomische Nutzen von Impfungen konnte auch für die Pneumokokkenimpfung durch die Analyse von Silvia Evers und Mitarbeitern der Universität Maastrich 2007 gezeigt werden.[49] Als obere Schranke galten dabei 50.000 Euro pro qualitätsgleichem Lebensjahr (QALY; 1 QALY entspricht einem in völliger Gesundheit verbrachten Lebensjahr). Maßnahmen, die weniger als 50.000 Euro pro QALY kosten, gelten Gesundheitsökonomen als kosteneffizient. Evers’ Analyse erstreckte sich auf zehn europäische Länder. Es ergaben sich Kosten-Nutzen-Verhältnisse zwischen 9239 (Dänemark) und 23.657 Euro pro QALY (Schweden). Deutschland rangiert in diesen Berechnungen mit 17.093 Euro pro QALY im Mittelfeld.
Weitere internationale Studien (z. B. zu Kinderlähmung, Keuchhusten oder Hepatitis B) bezüglich des ökonomischen Nutzens ergaben zum Teil beträchtliche Einsparungen durch Impfungen.[48]
Impfung mit fraktionierter Dosis
Eine Impfung mit einem Bruchteil der Standarddosis[50] kann erwogen werden, wenn der Impfstoff nicht in genügender Menge vorhanden ist, um den Bedarf einer Bevölkerung zu decken. Typische Szenarien sind ein limitiertes Gesundheitsbudget in armen Ländern oder die Frühphase einer Pandemie, wenn noch nicht genügend Impfstoff für alle vorhanden ist. Der Nutzen der Impfung mit fraktionierter Dosis (englisch fractional dose vaccination) setzt eine nichtlineare Dosis-Wirkungsbeziehung voraus, d. h. es können mit einer Teilimpfung (trotz reduzierter individueller Effektivität) auf Gesellschaftsebene mehr Krankheitsfälle verhindert werden als mit einer vollen Impfung nur eines Teils der Bevölkerung.[51] In randomisierten klinischen Studien wurde die Wirksamkeit dieser Strategie für Gelbfieber[50] und Kinderlähmung[52] gezeigt, und Modellrechnungen weisen auf ein relevantes Potential dieser Strategie zur Verkürzung der Covid-19-Pandemie[53] und Verminderung der Anzahl Krankheits- und Todesfälle bei dieser Krankheit.
Wirkungsweise auf die Verbreitung von Infektionskrankheiten
| Krankheit | Übertragungsweg | R0 | Mindestanteil Immunisierter |
|---|---|---|---|
| Masern | Tröpfcheninfektion | 12–18 | 83–94 % |
| Mumps | Tröpfcheninfektion | 4–7 | 75–86 % |
| Polio | fäkal-orale Infektion | 5–7 | 80–86 % |
| Röteln | Tröpfcheninfektion | 5–7 | 80–85 % |
| Pocken | Tröpfcheninfektion | 6–7 | 83–85 % |
| Die Basisreproduktionszahl R0 gibt an, wie viele weitere Personen eine infizierte Person ansteckt, falls die sie umgebende Population oder Subpopulation weder geimpft noch anderweitig vor Infektionen geschützt wird. | |||
Impfungen wirken auch auf die Verbreitung von Infektionskrankheiten in einer Bevölkerung. Das Spezialgebiet der mathematischen Modellierung in der Epidemiologie untersucht das epidemiologische Verhalten von Infektionskrankheiten und kann die Auswirkungen von Impfprogrammen berechnen. Hohe Durchimpfungsraten in einer Population können unter bestimmten Bedingungen zusätzlich zur Immunität der Geimpften auch eine Herdenimmunität (kollektive Immunität) bewirken, die auch dem Schutz von Ungeimpften vor einer Erkrankung dient, weil durch den hohen Anteil Immunisierter die Zirkulation des Erregers innerhalb der Population eingeschränkt wird. Der Herdeneffekt verringert das Risiko einer Exposition von Ungeimpften wie Säuglingen, älteren Menschen oder immundefizienten Patienten gegenüber Erregern, gegen die sie selbst nicht immun sind.
Wird beim lokalen Ausbruch einer Infektionskrankheit versucht, durch eine rasche Impfaktion noch eine Herdenimmunität aufzubauen, spricht man auch von einer Riegelimpfung.
Nach Einschätzung des Robert Koch-Instituts gehören Impfungen zu den „wichtigsten und wirksamsten präventiven Maßnahmen, die in der Medizin zur Verfügung stehen“.[55] So haben umfassende Impfprogramme seit Mitte des 20. Jahrhunderts zur massiven Reduktion verschiedener Infektionskrankheiten oder sogar zu deren regionaler oder – wie im Falle der Pocken – globaler Ausrottung geführt.[56][57] Zudem tragen sie zu einer Reduktion der Sterblichkeit bei Kindern bei, was Untersuchungen in den Niederlanden ergeben haben.[58] Mithin zählt die Gesundheitsbehörde der USA, die Centers for Disease Control and Prevention (CDC), die Impfung zu den zehn herausragenden Errungenschaften der Medizin und des öffentlichen Gesundheitswesens.[59][60] Die Impfung ist damit der bedeutsamste Teil der Dispositionsprophylaxe innerhalb des allgemeinen Infektionsschutzes.
Noch im zwanzigsten Jahrhundert kam es bis zur Eradikation der Pocken 1978 zu weltweit geschätzten 375 Millionen Todesfällen, weitere inzwischen durch Impfung kaum noch auftretende Infektionskrankheiten forderten in den USA im zwanzigsten Jahrhundert noch 39 Millionen Erkrankungen. Es wird geschätzt, dass weiterhin jährlich 1,5 Millionen Kinder (drei pro Minute) an durch Impfung verhinderbaren Infektionen sterben.[61]
Impfprogramme
Pocken

Die Pocken, auch Blattern genannt, sind eine gefährliche Infektionskrankheit. Das Pockenvirus kann direkt von Mensch zu Mensch durch Tröpfcheninfektion beim Husten übertragen werden. Symptome sind starkes Fieber, Schüttelfrost und die typischen Bläschen an fast allen Stellen des Körpers, die zu Pockennarben führen. In schwereren Fällen können Erblindung, Taubheit, Lähmungen oder Hirnschäden auftreten sowie in 30 % der Fälle der Tod.
Durch ein konsequentes Impf- und Bekämpfungsprogramm der Weltgesundheitsorganisation WHO und anderer Gesundheitsorganisationen wurde erreicht, dass 1980 die Welt von der WHO für pockenfrei erklärt werden konnte. Der weltweit vorletzte Fall wurde im Jahr 1977 in Merka (Somalia) bei einem nicht geimpften Koch dokumentiert. Durch die Impfung von über 50.000 Menschen in seiner Umgebung wurde sichergestellt, dass von dort keine Epidemie mehr entstehen konnte.[62] Der letzte Todesfall ereignete sich im Jahre 1978 bei der britischen Fotografin Janet Parker.
Die Pockenimpfung selbst ist eine nicht ganz komplikationsfreie Impfung mit einem Lebendimpfstoff und wird heutzutage nicht mehr durchgeführt, da keine unmittelbare Bedrohung mehr besteht. Dennoch sind weitere Pockeninfektionen, z. B. durch Laborunfälle oder Bioterrorismus, nicht völlig ausgeschlossen.
Kinderlähmung
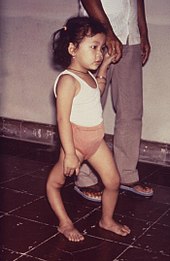
Die Kinderlähmung oder Poliomyelitis ist eine durch das Poliovirus übertragene Infektionskrankheit. Während die meisten Erkrankungen einen unkomplizierten und nahezu symptomfreien Verlauf aufweisen, verlaufen 10–20 % schwerwiegender mit starken Kopfschmerzen, Nackensteifigkeit, gastrointestinalen Symptomen und Muskelschmerzen. Bei 0,1 % aller Infektionen werden weiterhin die Nervenzellen des Rückenmarkes und/oder des Gehirns von dem Virus direkt befallen: dies ist die paralytische Poliomyelitis-Form, bei der dauerhafte Lähmungen auftreten. Bei den letzten größeren Epidemien in Deutschland 1952/53 wurden immerhin 15.000 paralytische Fälle bekannt. Diese Lähmungen führen in 1–4 % der Fälle zum Tode. Neben diesen akuten Folgen entwickeln bis zu 60 % der Menschen, die früher wegen akuter Poliomyelitis im Krankenhaus behandelt werden mussten, noch Jahre später Post-Poliomyelitis-Symptome, etwa in Form von starken Ermüdungserscheinungen, Muskelkrämpfen, Schmerzen.
Österreich führte 1961 auf gesetzlicher Grundlage eine großangelegte und bundesweite Massenimpfkampagne durch, die es im Westen bis dahin noch nicht gegeben hatte.[63] Im Jahr 1962 (in der DDR bereits ab 1960) wurde die orale Poliomyelitis-Schutzimpfung in Deutschland wie auch in anderen europäischen Ländern eingeführt. Bereits 1965, nur vier Jahre nach Beginn der ersten Impfkampagne, hatte sich die Zahl der im Bundesgebiet erfassten Erkrankungen auf weniger als 50 Neuerkrankungen reduziert. Im Vergleich zu den 4.670 gemeldeten Neuerkrankungen im Jahr 1961 war das ein Rückgang um 99 %. Die letzten beiden einheimischen Erkrankungen durch Polio-Wildviren traten in Deutschland in den Jahren 1986 und 1990 auf, die letzten importierten Fälle wurden 1992 erfasst.
Die „Schluckimpfung“ gegen Polio war die Ursache für eine seltene, aber schwerwiegende Impfkomplikation: Vermehrungsfähige, abgeschwächte Impfviren konnten in das Wildtypvirus rückmutieren und mit einer Häufigkeit von 1:890.000 bei der Erstimpfung eine Vakzine-assoziierte Poliomyelitis (VAPP) verursachen. Da das Poliovirus inzwischen aus Europa weitgehend verschwunden ist, wurde dieses Risiko als nicht mehr akzeptabel erachtet. Deshalb wird seit 1998 gegen Polio ein Totimpfstoff (IPV) ohne dieses Nebenwirkungsrisiko injiziert.

Im Jahr 1980, nach offizieller Ausrottung der Pocken, setzte sich die WHO die globale Ausrottung der Poliomyelitis als Ziel. Drei der sechs WHO-Regionen werden inzwischen als „Polio-frei“ bezeichnet (Amerika 1994, Westpazifik 2000, Europa 2002). Durch ausgedehnte Impfprogramme konnte Polio auch weitestgehend in Afrika und Asien zurückgedrängt werden. Inzwischen gelten nur noch wenige Länder als endemisch für Polioviren (Nigeria, Pakistan, Afghanistan). Bei nachlassenden Impfbemühungen in den Nachbarländern kommt es jedoch immer wieder zu Ausbrüchen der Poliomyelitis durch Re-Importe, zuletzt 2006 in Namibia.[64] Seit Januar 2014 gilt die Poliomyelitis in Indien als ausgerottet.[65]
Da die Poliomyelitis noch nicht ausgerottet ist, ist die Gefahr auch für Europa noch nicht gebannt. So kam es beispielsweise in einem Teil der Niederlande in den Jahren 1992/93 – also mitten im sonst schon Polio-freien Europa – zu einer regionalen Polio-Epidemie, die innerhalb weniger Wochen trotz der relativ kleinen Bevölkerungszahl Dutzende von lebenslang Gelähmten und einige Tote zur Folge hatte. Ein Teil der Bevölkerung dort verweigert aus religiösen Gründen jede Impfung. Abgesehen davon ist dieser Teil der niederländischen Bevölkerung genauso gut gebildet, gesundheitlich und mit Nahrung und Wohnungen versorgt usw. wie der Rest des Landes. Die Analyse des Virus ergab, dass der spezielle für diesen Ausbruch verantwortliche Virusstamm wahrscheinlich nicht von außen importiert worden war, sondern innerhalb der nicht geimpften Population überlebt hatte.[66] Bei Nachlassen der Polio-Durchimpfungsraten könnte die Kinderlähmung somit rasch wieder nach Europa zurückkehren.
Masern


Neben der Poliomyelitis hat die WHO auch die globale Eliminierung der Masern als Ziel vorgegeben. Derzeit (Stand 2005) ist dies auf den Kontinenten Amerika und Australien sowie in Skandinavien erreicht worden. Seit 1973 wird die Masern-Impfung in Deutschland empfohlen, und heutzutage werden etwa 90 % Durchimpfungsraten bei Schulanfängern erreicht. Die bundesweite Inzidenz der Masern im Jahr 2004 betrug deutschlandweit 0,15 pro 100.000 Einwohner (121 gemeldete Masernfälle insgesamt). Sie lag damit erstmals in allen Bundesländern unter dem Schwellenwert von 1 pro 100.000 Einwohner. Dennoch entstehen immer wieder lokale Ausbrüche der Masern, von denen insbesondere ungeimpfte Kinder betroffen sind, beispielsweise Masernepidemien mit schweren Komplikationen und Todesfällen in Hessen, Bayern, Baden-Württemberg und Nordrhein-Westfalen in den Jahren 2005 bis 2008.[67] Im Jahr 2005 wurden dem Robert Koch-Institut 780 Masernerkrankungen gemeldet (0,95 Fälle pro 100.000 Einwohner), 2006 waren es bis September bereits 2242 (2,72 Fälle pro 100.000 Einwohner).[68] Diese Ausbrüche bleiben dank der hohen Durchimpfung jedoch meist regional begrenzt.
Die Schweiz wurde seit 1999 von drei Masernepidemien betroffen: im Jahr 2003, von Ende 2006 bis Sommer 2009 und im Jahr 2011. Der Ausbruch 2006–2011 war erheblich, insgesamt wurden 4371 Fälle gemeldet.[69] Eine schlechte Durchimpfungsrate wird für den starken Ausbruch verantwortlich gemacht.[70] Weltweit sind die der WHO gemeldeten Erkrankungen von etwa vier Millionen (Durchimpfung 13 %) im Jahr 1980 auf etwa 500.000 Fälle (Durchimpfung 80 %) im Jahr 2003 und 139.300 Fälle (Durchimpfung 85 %) im Jahr 2010 gesunken.[71]
Weitere laufende Impfprogramme
Bei anderen Infektionskrankheiten wie Diphtherie, Tetanus, Keuchhusten und anderen ist zwar eine weltweite Ausrottung nicht erreichbar, aber die in deutschsprachigen und vielen anderen Ländern erreichten Erfolge der Schutzimpfung sind sehr eindrucksvoll. Beispielsweise wurde seit 2000 kein Erkrankungsfall der Diphtherie mehr in Deutschland gemeldet. Gegenwärtig sind 97 % der Kinder mit vorhandenem Impfausweis ausreichend gegen Diphtherie geimpft. Bei den Erwachsenen haben nur noch etwa 30 % Antikörper in schützender Menge, weil ihnen vielfach Auffrischimpfungen fehlen, die in 10-jährigem Abstand vorgenommen werden sollten. Ungeschützte Jugendliche und Erwachsene sind daher gegenwärtig Nutznießer der hohen Populationsimmunität bei den Kindern. Bei Kontakt zu einem importierten Erkrankungsfall, bei Kontakten zu infizierten Personen aus Epidemie- oder Endemiegebieten oder bei Reisen in Endemiegebiete sind sie jedoch gefährdet.
Bei der Bekämpfung des Keuchhustens (Pertussis) wurden im alten Bundesgebiet und in der DDR unterschiedliche Strategien verfolgt. Von 1974 bis 1991 wurde die Impfung in der BRD aus Furcht vor einzelnen Impfnebenwirkungen nur noch für Kinder mit individuell hohem Erkrankungsrisiko empfohlen. Dies führte zu einer sehr niedrigen Impfquote (weniger als zehn Prozent) und einer entsprechend hohen Erkrankungsrate bei Säuglingen und Kindern. In der DDR war die Pertussis-Schutzimpfung seit 1964 etabliert, es wurden Impfquoten von rund 90 % erreicht. Der Keuchhusten war bei den Klein- und Schulkindern weitgehend eliminiert, die noch nicht geschützten Säuglinge profitierten vom Impfschutz ihrer älteren Geschwister. Direkt nach der Wiedervereinigung kam es in den neuen Bundesländern zu einem deutlichen Rückgang der Impfquoten und nachfolgend zu einem Wiederanstieg der Morbidität, was sich aufgrund der fortgesetzten Erfassung durch Meldung der Pertussis in den neuen Bundesländern nachweisen lässt: Es folgte ein Anstieg von 0,2 Erkrankungen pro 100.000 Einwohner im Jahr 1991 auf 20,4 Erkrankungen pro 100.000 Einwohner im Jahr 2000. Weder die Impfung noch die abgelaufene Erkrankung mit Keuchhusten garantieren einen lebenslangen Schutz vor einer neuen Erkrankung. Keuchhusten ist nur für Kleinkinder gefährlich, für alle anderen belastend und langwierig. Zudem führt die Behandlung auch zu einem massiven Antibiotika-Einsatz in den betroffenen Familien mit der Gefahr einer vermehrten Resistenzentwicklung in der Bevölkerung. Dies wäre bei einer Erhöhung der Impfimmunität vermeidbar (diese liegt bei Kindern derzeit (Stand 2005) bei 87 %). Der Versuch einer weitgehenden Eliminierung dieser Erkrankung würde regelmäßige Wiederimpfungen sowohl bei Jugendlichen als auch bei Erwachsenen erfordern.[72][73]
Mittlerweile konnte die Pneumokokkenimpfung ihre Wirksamkeit auf epidemiologischer Ebene nachweisen. Sie senkte bei den unter Zweijährigen drastisch die Zahl der Hospitalisierungen durch Lungenentzündungen.[74]
Neue Impfungen und Entwicklungen
Impfstoffe gegen die meisten Arten von Enteroviren, gegen Hepatitis C, Tuberkulose, Syphilis, Gonorrhoe, HIV und durch Parasiten wie Plasmodien ausgelöste Krankheiten wie insbesondere die Malaria stehen bisher nicht zur Verfügung. Mehrere neue Impfstoffe befinden sich aber in der Entwicklung, Zulassung oder bereits Markteinführung:
In Europa und den USA sind seit 2006 zwei Impfstoffe[75] gegen Humane Rotaviren, die Erreger schwerer Durchfallerkrankungen bei Säuglingen und Kleinkindern, zugelassen. Die Food and Drug Administration ließ im Frühjahr/Sommer 2006 in den USA einen Impfstoff gegen bestimmte Papillomaviren zu,[76] die neben Genitalwarzen auch Gebärmutterhalskrebs verursachen. Dieser Impfstoff, der inzwischen in Deutschland zugelassen wurde und in den meisten Ländern Europas schon erhältlich ist, ist somit neben dem gegen das Hepatitis-B-Virus ein weiterer, der auch der Prävention gegen bestimmte Krebsarten dient. Im Jahr 2010 wurde in den USA ein therapeutischer Impfstoff zur Behandlung von Prostatakrebs zugelassen.[77]
Auch alte Impfstoffe werden im Zuge eines Impfstoffdesigns beständig weiterentwickelt, um die Reinheit der Produkte zu verbessern, die Wirkung und die Ansprechraten zu erhöhen. So werden heute viele Impfstoffe nicht mehr durch chemische Inaktivierung eines Erregers hergestellt, sondern durch Gentechnik lassen sich gezielt bestimmte immunogene Teile eines Erregers produzieren. Durch die gezielte Antigen-Auswahl wird so das Immunsystem eines Patienten trotz größerer Anzahl an verfügbaren Impfstoffen weniger Antigenen insgesamt ausgesetzt. Auch neue Applikationsformen werden entwickelt, beispielsweise soll die nasale Applikation eines neuen Influenza-Impfstoffs den natürlichen Infektionsweg besser imitieren.[78] Durch einen adoptiven Zelltransfer kann eine Immunisierung ex vivo durchgeführt werden.
Aussichtsreich sind aber auch neue Impfstoffe, beispielsweise gegen Helicobacter pylori, den Haupterreger von Magen- und Zwölffingerdarmgeschwüren, und gegen das Herpes-simplex-Virus, einen Verursacher von Herpes simplex. An verschiedenen Impfstoffen gegen die Tropenkrankheit Malaria wird geforscht.[79]
Die Entwicklung von Impfstoffen gegen HIV, das Epstein-Barr-Virus (Auslöser des Pfeifferschen Drüsenfiebers), viele Krebs-Arten, weitere Durchfallerkrankungen und viele andere Infektionskrankheiten befinden sich noch in einer frühen klinischen Entwicklungsphase.[80]
Impfmüdigkeit und Gegenmaßnahmen

Durch die sogenannte „Impfmüdigkeit“, d. h. die Vernachlässigung oder bewusste Ablehnung der empfohlenen Schutzimpfungen, treten manche Infektionskrankheiten wieder vermehrt auf. Sinkt die Durchimpfungsrate unter die kritische Schwelle für die Herdenimmunität, stellt die Impfmüdigkeit zudem eine für Risikogruppen wie Säuglinge, Alte und immundefiziente Patienten lebensbedrohende Verhaltensweise dar.
Eine Ursache der Impfmüdigkeit liegt neben der unten dargestellten Impfkritik in der großen Wirksamkeit der Impfungen selbst und dem durchschlagenden Erfolg der staatlichen Impfprogramme begründet: Zahlreiche Krankheiten, die vor wenigen Generationen noch weit verbreitet und gefürchtet waren, haben ihren Schrecken verloren, da sie heute kaum noch jemand aus eigener Anschauung kennt.[81] Infolgedessen bestehen bei Kindern vor allem bei der Mumps-Masern-Röteln- und der Hepatitis-B-Impfung mittlerweile große Impflücken. Termine zur Nachimpfung werden häufiger nicht wahrgenommen, und insbesondere Erwachsene versäumen Auffrischimpfungen gegen Tetanus und Diphtherie. Deshalb kommt es immer wieder zu lokalen Epidemien von Infektionskrankheiten, zum Beispiel in Nordrhein-Westfalen 2006 zu einer Masern-Epidemie mit über 2000 Erkrankten.[67] Epidemiologen beobachten mit wachsender Sorge ein Absinken der Impfquoten in Deutschland und anderen Industrienationen: So lag die Durchimpfungsquote z. B. bei Masern im Jahr 2009 in manchen Fällen schon bei unter 80 Prozent der Bevölkerung, in Deutschland sogar nur um 70 Prozent.[82][83] Dies liegt weit unter der von der WHO für die hochansteckenden Masern empfohlenen Durchimpfung von mindestens 95 Prozent der Bevölkerung, die notwendig wäre, um Krankheitsausbrüche in der Bevölkerung wirksam zu verhindern.[83][84][85]
Daher ist es erklärtes Ziel der Gesundheitsbehörden, die Grundimmunisierungen und Auffrischimpfungen flächendeckend durchzuführen, um die Herdenimmunität der Bevölkerung aufrechtzuerhalten. Als Maßnahmen gegen die Impfmüdigkeit gibt es öffentliche Impfempfehlungen der Gesundheitsämter (Impfkalender) und die Europäische Impfwoche der Weltgesundheitsorganisation (WHO).
Das „Epidemiologie-Gesetz“ (Gesetz zur Modernisierung der epidemiologischen Überwachung übertragbarer Krankheiten) ist im Juli 2017 in Kraft getreten.[86] Hierbei müssen bundesweit die Leitungen von Kindertageseinrichtungen Eltern, die an der verpflichtenden Impfberatung für ihre Kinder nicht teilnehmen, künftig beim Gesundheitsamt melden. Es ist keine Impfpflicht, sollte aber Impflücken schließen.[87] Bereits 2015 hatte das Präventionsgesetz Eltern bundesweit verpflichtet, vor dem ersten Besuch ihres Kindes in einer Kita (oder einem Kindergarten) sich zu den empfohlenen Impfungen beraten zu lassen.
Empfohlene Impfungen
Der Impfkalender der ständigen Impfkommission, der einen Überblick über die in Deutschland empfohlenen Impfungen gibt, sieht wiederholte Impfungen ab dem Säuglingsalter vor: beginnend mit dem 3. Lebensmonat (9. Lebenswoche) bis zum 18. Lebensjahr sollen Kinder gegen verschiedene Krankheitserreger geimpft werden. Für die betreuenden Ärzte besteht die Pflicht, über Vor- und mögliche Nachteile der Impfung aufzuklären. Eine Impfung stellt – wie andere medizinische Behandlungsmaßnahmen auch – juristisch gesehen eine Körperverletzung dar. Die Körperverletzung ist nur dann nicht rechtswidrig, wenn die Einwilligung des Behandelten oder der Eltern vorliegt oder ein Vormundschaftsgericht die Einwilligung der Eltern ersetzt.[88] Die Aufklärung des Behandelten oder der Eltern ist die Grundlage dieser Einwilligung. Die Verantwortung der Eltern bezieht sich dabei in erster Linie darauf, ihr Kind vor schweren Krankheiten zu schützen, in zweiter jedoch auch auf die Gesellschaft. Seuchenartige Ausbrüche von Infektionskrankheiten können nur dann wirkungsvoll verhindert werden, wenn ein möglichst hoher Prozentsatz der Bevölkerung geimpft ist. Um dieses Ziel zu erreichen, sind je nach Krankheit und Wirksamkeit des Impfstoffs Durchimpfungsraten von etwa 90 % erforderlich. Näheres zur Berechnung dieser Durchimpfungsraten siehe Epidemiologie: Reproduktionsrate, Mathematische Modellierung der Epidemiologie. Eine Impfpflicht besteht in Deutschland nicht.
Die Empfehlungen der Ständigen Impfkommission sind in Deutschland Grundlage für die Festlegung der „öffentlich empfohlenen Impfungen“. Letztere werden durch die Gesundheitsbehörden der Bundesländer definitiv festgelegt. Falls durch eine öffentlich empfohlene Impfung ein bleibender Schaden entsteht (dann Impfschaden genannt – im Gegensatz zur Impfreaktion und Impfkomplikation), besteht ein Anspruch auf Entschädigung durch das Versorgungsamt. Seit 1. April 2007 ist der Kostenträger für alle Impfungen, die laut der Kommission empfohlen werden, die Krankenkasse. Der Patient braucht hierzu nichts zu zahlen. In der Schweiz erfolgt die Empfehlung durch das Bundesamt für Gesundheit und die Schweizerische Kommission für Impffragen. In Österreich wird der Impfplan vom Obersten Sanitätsrat (Impfausschuss) des Bundesministeriums für Gesundheit und Frauen herausgegeben.
Die Empfehlungen der STIKO beruhen auf einer wissenschaftlichen Beurteilung der Risiken eines Menschen, sich selbst mit einem Krankheitserreger zu infizieren, andere zu infizieren, hospitalisiert bzw. Patient auf einer Intensivstation zu werden oder zu versterben. Von diesen Empfehlungen sind rechtsverbindliche Aussagen über den Impfstatus eines Menschen zu unterscheiden. So wurde z. B. während der COVID-19-Pandemie in Deutschland nach Beginn der Möglichkeit, Menschen gegen SARS-CoV-2 zu impfen, zunächst zwischen den drei Statusgruppen der „vollständig Geimpften“, der „Genesenen“ und der „nicht geimpften Personen“ unterschieden. Diese Unterscheidung ist Grundlage für 3G- und 2G-Regeln. Die Zuordnung zu einer der drei Statusgruppen bestimmt das Ausmaß der Einschränkung von Freiheitsrechten, das gruppenspezifisch unterschiedlich ist.
Empfehlungen für Deutschland, Schweiz und Österreich
Folgende Impfungen werden im Januar 2023 von der Ständigen Impfkommission in Deutschland empfohlen.[89] Diese Empfehlungen entsprechen weitestgehend dem Impfplan der Schweiz[90] und dem Impfplan von Österreich.[91]
| Impfung gegen | Empfehlung der STIKO (Auszug) |
|---|---|
| Affenpocken (und andere Orthopocken) | Erwachsene MSM; Personal in Speziallaborien |
| Cholera | Aufenthalte in Infektionsgebieten unter mangelhaften Hygienebedingungen bei aktuellen Ausbrüchen |
| COVID-19 | Alle Personen ab 12 Jahren (für Frühling/Sommer 2023 in der Schweiz nicht mehr empfohlen)[92] |
| Diphtherie | Standard für Kinder ab zwei Monaten, Auffrischung für Erwachsene alle zehn Jahre |
| FSME | Exponierte zu Zecken in FSME-Risikogebieten (Anwohner, Forstarbeiter u. a.) |
| Gebärmutterhalskrebs / HPV | Kinder vom 9. bis zum vollendeten 14. Lebensjahr, Nachholimpfungen bis zum Alter von 17 Jahren. |
| Gelbfieber | Bei Reisen in Gelbfieber-Endemiegebieten (tropisches Afrika, Südamerika), teilweise sogar vorgeschrieben (Ziel- oder Transitländer); gezielten Tätigkeiten mit Exposition zum Gelbfieber-Virus (z. B. Laboratorien) |
| Haemophilus influenzae Typ b | Standard für Kinder ab zwei Monaten Personen mit anatomischer oder funktioneller Asplenie |
| Hepatitis A | Risikogruppen (z. B. bei Sexualverhalten mit erhöhtem Expositionsrisiko) Gefährdetes Personal (Gesundheitsdienst, Forschung, Kanalisation u. a.), Reisende in Epidemiegebieten |
| Hepatitis B | Standard für Kinder ab zwei Monaten Risikogruppen Gefährdetes Personal in Gesundheitsdienst, Reiseindikation |
| Herpes Zoster (Gürtelrose) | Impfung mit einem Totimpfstoff bei allen Personen ab einem Alter von 60 Jahren und bei allen Personen ab einem Alter von 50 Jahren, infolge einer Grundkrankheit |
| Influenza | Personen ab 60 Jahre Personen mit geschwächtem Immunsystem Personen mit chronischen Erkrankungen Personen mit erhöhter Gefährdung bzw. direktem Kontakt mit Geflügel/Wildvögel |
| Japanische Enzephalitis | Bei Reisen in Endemiegebiete (Südostasien, weite Teile von Indien, Korea, Japan, China, West-Pazifik, Nordaustralien) während der Übertragungszeit
Gefährdetes Personal (Forschung) |
| Masern | Nach 1970 geborene Personen ≥ 18 Jahre mit unklarem Impfstatus, ohne Impfung oder mit nur einer Impfstoffdosis in der Kindheit
Standard für Kinder ab elf Monaten Säuglinge von sechs bis acht Monaten in Ausnahmefällen nach individueller Risiko-Nutzen-Abwägung (Off-Label-Use) |
| Meningokokken Gruppe A, C, W, Y | Personen mit geschwächtem Immunsystem
Schüler/Studenten vor Langzeitaufenthalten in Ländern mit Impfempfehlung Reisende in Länder mit epidemischem Vorkommen, mit Krankheitsausbrüchen und Impfempfehlung für die einheimische Bevölkerung Pilgerreisende nach Mekka Gefährdetes Laborpersonal |
| Meningokokken Gruppe B | Personen mit geschwächtem Immunsystem
Schüler/Studenten vor Langzeitaufenthalten in Ländern mit Impfempfehlung Gefährdetes Laborpersonal |
| Mumps | Standard für Kinder ab elf Monaten |
| Pertussis (Keuchhusten) | Standard für Kinder ab zwei Monaten, Auffrischung mit fünf bis sechs Jahren, und zwischen dem 9. und 17. Lebensjahr. Alle Erwachsenen, vor allem bei möglichem Kontakt zu Neugeborenen und Säuglingen (Paare mit Kinderwunsch, werdende Eltern und Großeltern etc.) Personal im Gesundheitsdienst |
| Pneumokokken | Standard für Kinder ab zwei Monaten bis zwei Jahren Personen über 60 Jahre Personen mit geschwächtem Immunsystem und chronischen Erkrankungen Berufliche Tätigkeiten wie Schweißen und Trennen von Metallen |
| Poliomyelitis | Standard für Kinder ab zwei Monaten/u. U. Auffrischung
Personal mit Kontakt zu Erkrankten / Reiseindikation |
| Röteln | Standard für Kinder ab elf Monaten |
| Rotavirus | Schluckimpfung ab der sechsten Lebenswoche, je nach Impfstoff zwei- oder dreimal im Abstand von vier Wochen |
| Tetanus | Standard für Kinder ab zwei Monaten, Auffrischung für Erwachsene alle zehn Jahre und ggf. im Verletzungsfall |
| Tollwut | Personen mit Umgang mit Tieren in Gebieten mit Wildtiertollwut (Tierärzte, Jäger, Forstpersonal u. a.) |
| Typhus | Bei Reisen in Endemiegebiete mit Aufenthalt unter schlechten hygienischen Bedingungen |
| Windpocken | Standard für Kinder ab elf Monaten Seronegative Personen bei Indikation (Organtransplantation, Kinderwunsch bei Frauen u. a.) Seronegatives Personal im Gesundheitswesen |
Schwangerschaft und Stillzeit
Nach aktuellen Empfehlungen des in Deutschland dafür zuständigen Robert Koch-Instituts sind Impfungen mit Lebendimpfstoffen ab drei Monaten vor einer und während der gesamten Schwangerschaft kontraindiziert. Dagegen können fällige Impfungen mit Totimpfstoffen den werdenden Müttern im zweiten und dritten Drittel der Schwangerschaft bedenkenlos verabreicht werden; im ersten Drittel sollten zum Ausschluss jeglichen Risikos für das Kind dagegen nur diejenigen Totstoff-Impfungen vorgenommen werden, die individuell dringend indiziert sind. In der anschließenden Stillzeit sind Impfungen generell ohne Beschränkungen möglich.[93]
Autoimmunerkrankungen und immunsuppressive Therapien
Die Ständige Impfkommission (STIKO) am Robert Koch-Institut (RKI) klassifiziert Menschen mit Immunschwäche als Risikogruppe für verschiedene opportunistische Infektionskrankheiten.[89][94]
Unter diese Patientengruppe fallen neben Personen mit Autoimmunkrankheiten (und chronisch-entzündlichen Erkrankungen wie zum Beispiel Morbus Crohn) auch Patienten, deren körpereigene Abwehrmechanismen durch immunmodulatorische oder immunsuppressive Therapien geschwächt sind.[95] Patienten mit Immunschwäche erkranken durchschnittlich häufiger an impfpräventablen Infektionen und leiden zudem öfter an schweren Verläufen als immungesunde Personen.[89][95] Zusätzlich können Infektionserkrankungen bei Patienten mit Immundefekt erneute Schübe der Grunderkrankung auslösen. Dagegen stehen Schutzimpfungen selbst nicht in Verdacht, neue Autoimmunkrankheiten zu verursachen oder eine bestehende zu verschlechtern.[95]
Gemeinsam mit Vertretern verschiedener medizinischer Fachgesellschaften hat die STIKO daher Anwendungshinweise zu bestimmten Indikationsimpfungen für Personen mit Immundefizienz bzw. Immunsuppression formuliert:[94][95] Diese umfassen insbesondere Totimpfstoffe, die als sicher für Patienten mit Immundefekt gelten, beispielsweise gegen Influenza, Herpes Zoster, Pneumokokken und Meningokokken der Serogruppen A, C, W, Y und B.[96][95]
Die Gabe von Lebendimpfstoffen, etwa gegen Mumps-Masern-Röteln, Varizellen oder Rotaviren, kann dagegen während einer laufenden immunsuppressiven Therapie mit Komplikationen einhergehen. Deshalb ist sie häufig kontraindiziert und stets von ärztlichen Einzelfallentscheidungen abhängig.[95] Es wird empfohlen, die Impfungen bis spätestens vier Wochen vor Therapiebeginn zu geben.[96][95] Als weitere Infektionsprävention gilt außerdem der vollständige Impfschutz direkter Kontaktpersonen.[89][95]
Kombinationsimpfungen
Kombinationsimpfstoffe sind Impfstoffe, die unterschiedliche Komponenten gegen verschiedene Infektionskrankheiten in sich vereinigen und somit Schutz gegen diese Krankheiten mit einer Impfung gewährleisten können. Empfohlen werden Kombinationsimpfungen mit diesen Impfstoffen, weil sie die Handhabung vereinfachen, die Zahl der Injektionen sowie der Impftermine verringern und somit die Kosten senken sowie die Durchimpfungsrate der Bevölkerung verbessern. Die geringere Anzahl der Injektionen ist insbesondere für den Patienten, gerade bei Kindern, angenehmer. Nähere Informationen zu den einzelnen Mehrfachimpfstoffen können den jeweiligen Artikeln zu diesen Impfstoffen entnommen werden.
Der MMR-Impfstoff ist eine Kombinationslebendimpfung gegen Masern, Mumps und Röteln. Seit 2006 ist auch ein MMRV-Impfstoff in Deutschland zugelassen, mit einer zusätzlichen Komponente gegen Varizellen (Windpocken).[97] Die ständige Impfkommission am Robert Koch-Institut empfiehlt im September 2011, dass für die erste Impfung gegen Masern, Mumps, Röteln und Varizellen zunächst die getrennte Gabe der kombinierten Masern-Mumps-Röteln-Impfung einerseits und einer Varizellen-Impfung andererseits bevorzugt werden sollte und die zweite Impfung dann mit dem MMRV-Kombinationsimpfstoff erfolgen kann.[98]
Im Oktober 2000 wurden erstmals auch hexavalente Impfstoffe in der Europäischen Union zugelassen, die gegen sechs Infektionskrankheiten schützen sollen: Kinderlähmung, Diphtherie, Tetanus, Keuchhusten, Haemophilus influenzae Typ b-Infektionen sowie Hepatitis B. Als Alternative bietet sich für Säuglinge die Fünffachimpfung mit gesonderter Immunisierung gegen Hepatitis B an. Dies bedeutet aber jeweils eine zusätzliche Injektion. Eine Infektion mit Hepatitis B ist bei Säuglingen zwar sehr selten, jedoch sind die Folgen schwerwiegend, sodass die Sechsfach-Impfung in Deutschland empfohlen wird und sich inzwischen durchsetzt.
Als weitere Kombinationen kennt man u. a. DTP-Impfstoffe gegen Diphtherie, Tetanus und Pertussis (Keuchhusten), DTP-IPV-Impfstoffe gegen Diphtherie, Tetanus, Pertussis (Keuchhusten) und Poliomyelitis (Kinderlähmung) sowie einen Kombinationsimpfstoff gegen Hepatitis A und B.
Eine Gefahr des „Überimpfens“, also zusätzliche Impfungen bei bereits bestehenden Impfschutz, besteht nicht.[99] Nach sehr häufigen Impfungen mit Tetanus- und/oder Diphtherietoxoid wurden zwar in Ausnahmefällen lokale Nebenwirkungen wie eine ausgeprägte Unverträglichkeitsreaktion mit schmerzhafter Schwellung und Rötung der betroffenen Extremität (sogenanntes Arthus-Reaktion) beobachtet.[99] Insgesamt überwiegen aber die Vorteile eines zuverlässigen Impfschutzes für Personen ohne Impfdokumentation.[100] Daher kann bei Personen mit unklarem Impfstatus auch die Gabe von Kombinationsimpfstoffen verwendet werden, wenn nicht alle enthaltenen Antigene/Impfstoffkomponenten erforderlich sind.[99]
Impfpflicht
Ist eine Impfung gesetzlich vorgeschrieben, bezeichnet man dies als Impfpflicht. In der Bundesrepublik Deutschland bestand sie z. B. in den 1980er-Jahren gegen die Pocken für einzelne Personengruppen, in der DDR bestand eine umfassende Impfpflicht für die Gesamtbevölkerung.
Derzeit (Stand 2009) besteht in der Mehrzahl der Staaten der EU eine Impfpflicht für Menschen. In Deutschland besteht seit 2001 die Möglichkeit, die Impfpflicht jederzeit über eine einfache Rechtsverordnung anzuwenden und so die Bevölkerung zu schützen. Dies wird im Infektionsschutzgesetz (IfSG) mit dem folgenden Wortlaut geregelt: „§ 20 (6) Das Bundesministerium für Gesundheit wird ermächtigt, durch Rechtsverordnung mit Zustimmung des Bundesrates anzuordnen, dass bedrohte Teile der Bevölkerung an Schutzimpfungen oder anderen Maßnahmen der spezifischen Prophylaxe teilzunehmen haben, wenn eine übertragbare Krankheit mit klinisch schweren Verlaufsformen auftritt und mit ihrer epidemischen Verbreitung zu rechnen ist. Das Grundrecht der körperlichen Unversehrtheit (Artikel 2 Abs. 2 Satz 1 Grundgesetz) kann insoweit eingeschränkt werden. […]“. In der Schweiz sieht Artikel 23 Absatz 2 des Epidemiengesetzes[101] eine ähnliche Möglichkeit für Kantone vor, obligatorische Impfungen einzuführen.
Für Masern besteht seit März 2020 eine eingeschränkte Impfpflicht in Deutschland. Laut dem Masernschutzgesetz müssen alle nach 1970 geborenen Personen, die in einer Gemeinschaftseinrichtung betreut werden, einen Masernschutz nachweisen. Dies gilt auch für Personen, die bereits vier Wochen in einem Kinderheim betreut werden oder in einer Unterkunft für Geflüchtete untergebracht sind. Personen, die in Gesundheitseinrichtungen wie Krankenhäusern und Arztpraxen oder in Gemeinschaftseinrichtungen oder Gemeinschaftsunterkünften tätig sind, müssen ebenso den Masernschutz nachweisen.[102]
Bei Tierimpfungen existieren europaweit ähnliche Regelungen, beispielsweise besteht beim grenzüberschreitenden Verkehr für Hunde, Katzen und Frettchen Impfpflicht gegen Tollwut. In Deutschland ist die Impfpflicht im Tierseuchengesetz (TierSG) geregelt, auf dessen Grundlage gilt derzeit (Stand 2019) eine Impfpflicht für Rinder, Schafe und Ziegen gegen die Blauzungenkrankheit.[103]
Impfgegner

Menschen, die das Impfen generell ablehnen, werden Impfgegner genannt. Impfgegner sind entweder religiös motiviert oder haben Angst vor angeblichen oder möglichen Impfschäden (siehe dazu auch Pharmakovigilanz). Einige Impfgegner vermuten hinter Impfungen eine Verschwörung, andere leugnen gar die Existenz oder Pathogenität von Viren.[104] Die von Impfgegnern teilweise dogmatisch vorgebrachten Behauptungen sind allesamt wissenschaftlich widerlegt, das Phänomen gilt als verbreitete Verschwörungstheorie[105][37][106] sowie als Form der Wissenschaftsleugnung.[107] Die Weltgesundheitsorganisation zählt Impfgegner zu den weltweit zehn größten Gefahren für die Gesundheit der Menschheit.
Geschichte
Eine der weitverbreiteten Infektionskrankheiten waren die Pocken, an denen etwa 30 % der Erkrankten starben.[108] Überlebende waren häufig durch Narben entstellt. Früh erkannte man jedoch, dass das einmalige Durchstehen der Pockenkrankheit gegen weitere Ansteckungen durch die Pocken immun machte. Daher waren die Pocken die erste Krankheit, bei der versucht wurde, Individuen durch absichtliche Infektion zu immunisieren. Chinesische Ärzte wählten zur Gewinnung des Impfstoffs Personen mit leichtem Krankheitsverlauf aus und sammelten Krustenstücke der Pocken dieser Infizierten. Die Stücke wurden zu einem Pulver zermahlen und in die Nase der zu impfenden Person eingeführt. Die erste gesicherte schriftliche Quelle zu diesem Verfahren ist ein Traktat des Arztes Zhang Lu aus dem Jahr 1695.[109] Lady Mary Wortley Montagu berichtete 1718, dass die Türken sich in ähnlicher Weise den Körperflüssigkeiten von leicht Infizierten aussetzten, und wendete diese Methode bei ihren eigenen Kindern an.


Die Pockenepidemie in Boston 1721 war das erste Auftreten einer Virusepidemie in Nordamerika, bei der eine Impfung zur Eindämmung der Krankheit eingesetzt wurde. Zum damaligen Zeitpunkt war noch nicht bekannt, dass bei der Verabreichung von abgeschwächten Pockenviren eine Immunantwort ausgelöst wird, in der Regel jedoch keine Erkrankung. Es kam im Zuge der Epidemie zu einer heftig geführten Kontroverse um die Variolation, in deren Mittelpunkt als Befürworter der puritanische Prediger Cotton Mather und als sein Gegenspieler der Arzt William Douglass standen.[110] Cotton Mather erlangte das Wissen über die Variolation laut eigener Aussage 5 Jahre vor Ausbruch der Epidemie von einem von ihm versklavten Afrikaner, der nur als Onesimus bekannt ist. Onesimus erzählte ihm, er habe sich in Afrika, wie in seinem in seinem Volk üblich, einer "Operation" unterzogen, die gegen die Pocken immun mache. Nach Ausbruch der Epidemie wandten Mather und der Arzt Zabdiel Boylston das von Onesimus beschriebene Verfahren bei Freiwilligen an. Aufgrund der Verwerfungen von Sklaverei und Kolonialismus ist über das alte westafrikanische Wissen zur Innokulation wenig weiteres bekannt.[111][112]
Das Überstehen der Kuhpocken (eine beim Menschen leicht verlaufende Rinderkrankheit, genannt auch Melkerknoten) machte gegen weitere Ansteckungen durch die Pocken immun. Nachdem schon sechs Personen Menschen mit Kuhpockenlymphe immunisiert hatten (unter anderem Sevel, Jensen, Benjamin Jesty 1774, Rendall, Peter Plett 1791),[113] experimentierte auch der englische Arzt Edward Jenner (1749–1823) mit diesem Wissen und infizierte im Jahr 1796 einen Jungen mit den Kuhpocken. Der Junge erwies sich später als immun gegen gewöhnliche Pocken. Da der Impfstoff von Kühen stammte, nannte Jenner seinen Impfstoff Vaccine (von lat. vacca „Kuh“) und die Technik der künstlichen Immunisierung „Vaccination“ (von lat. vaccinus „von Kühen stammend“). Ein Pionier der Schutzimpfung in Deutschland war der aus Hannover stammende Arzt und Hofmedikus Georg Friedrich Ballhorn (1770–1805), der Jenners Publikation von 1798 bereits 1799 ins Deutsche[114] übersetzte, ab dem Frühjahr 1799 selbst Forschungen dazu anstellte und ab Januar 1800 erste Gegenimpfversuche unternahm.[115][116] Der Arzt Jean de Carro hatte als erster 1799 die Impfung auf dem europäischen Kontinent durchgeführt.[117] Diese erste moderne Art der Impfung gegen die Menschenpocken wurde rasch in Europa aufgegriffen. Der deutsche Arzt Theodor Christian Eulner, der als Arzt in Grönland arbeitete, versuchte 1800 mit Impfungen die Pockenepidemie in Grönland zu beenden.[118] Seit etwa 1810 wurde die Vaccination zur Pflicht.[119] Die Ursache der Infektionskrankheiten war jedoch nach wie vor unbekannt.
Dies änderte sich gegen Ende des 19. Jahrhunderts. Louis Pasteur formulierte 1864 die Keimtheorie, Robert Koch erbrachte 1876 den Nachweis der Krankheitserreger von Milzbrand (Bacillus anthracis) und 1881 den Nachweis des Tuberkulose-Bakteriums (Mycobacterium tuberculosis). Diese Entdeckung gilt als der endgültige Beweis der Existenz bakterieller Krankheitserreger. Schüler von Koch und Pasteur bauten das Konzept weiter aus. Pasteur entwickelte 1881 gemeinsam mit Émile Roux Impfstoffe gegen Milzbrand und 1885 gegen die Tollwut. Paul Ehrlich, Emil von Behring und Shibasaburo Kitasato nutzten 1890 das Wissen zur passiven Immunisierung gegen Diphtherie und Wundstarrkrampf.
Mit der Standardisierung von Impfstoffen begannen ab dem Ende des 19. Jahrhunderts die ersten nationalen Impfprogramme. Den Anfang machten Schutzimpfungen gegen Pocken, die u. a. in England (1867) und im Deutschen Reich (1874) per Gesetz als Pflichtimpfungen eingeführt wurden. Während in England die Impfpflicht bereits 1898 und 1907 wieder gelockert wurde, hielt man an ihr im Deutschen Reich fest.[120] Allerdings kam es durch Verunreinigungen in den frühen Impfstoffen auch zu Unfällen wie dem Lübecker Impfunglück im Jahr 1930, bei dem 77 Kinder infolge eines kontaminierten Impfstoffes starben, was in der deutschen Öffentlichkeit und unter Gesundheits-Experten für eine Diskussion um staatliche Impfprogramme sorgte. Der diesem Fall folgende Calmette-Prozess bildet in Deutschland den Anfang des modernen Medizinrechts.
Seit Mitte des 20. Jahrhunderts wurden systematisch zahlreiche weitere Impfstoffe gegen Infektionskrankheiten entwickelt, beispielsweise von Jonas Salk und Albert Sabin gegen die Kinderlähmung sowie ein Impfstoff gegen Gelbfieber durch Max Theiler. Während des Kalten Krieges kam es zum Teil zu einem „Wettlauf um die bessere Immunisierung“[121] zwischen den beiden Blöcken. Vor allem die DDR versuchte in Propagandaaktionen auf die Überlegenheit des ostdeutschen Gesundheitswesens hinzuweisen und dem Westen dessen „Impflücken“ vorzuhalten. Seit 1967 werden unter der Schirmherrschaft der Weltgesundheitsorganisation (WHO) weltweite Impfprogramme aufgelegt. In den folgenden Abschnitten sind einige Beispiele dazu aufgeführt.
Chronologie der Entwicklung und Einführung von Impfstoffen
| Infektionskrankheit | Auslöser | Impfstoff | Einführung | Anmerkungen |
|---|---|---|---|---|
| Pocken | Variola-Virus | Pockenimpfstoff | 1796 | erster Großversuch bereits 1714 in Konstantinopel (via Variolation).[122] Ab 1798 in internationalen Impfkampagnen angewendet.[123] |
| Tollwut | Rabiesvirus | Tollwutimpfstoff | 1885 | |
| Typhus | Salmonella-Typhi-Bakterien | Typhusimpfstoff | 1896 | |
| Cholera | Vibrio-Cholerae-Bakterien | Choleraimpfstoff | 1896 | |
| Pest | Yersinia pestis | Pestimpfstoff | 1897[123] | |
| Diphtherie | Corynebacterium-Diphtheriae-Bakterien | Diphtherieimpfstoff | 1923 | passive Immunisierung ab 1890 mit dem Diphtherie-Antitoxin |
| Keuchhusten | Bordetella-Pertussis-Bakterien | Pertussisimpfstoff | 1926 | |
| Tuberkulose | Mykobakterienarten | Tuberkuloseimpfstoff | 1927 | Impferfolg mit BCG unsicher, seit 1998 nicht mehr empfohlen |
| Tetanus | Clostridium-Tetani-Bakterien | Tetanusimpfstoff | 1927 | |
| Grippe | Influenzavirus | Influenzaimpfstoff | 1936 | |
| Gelbfieber | Gelbfieber-Virus | Gelbfieberimpfstoff | 1937 | |
| Fleckfieber | Rickettsien | Fleckfieberimpfstoff | 1938[123] | |
| Kinderlähmung | Poliovirus | Polioimpfstoff | 1955/1960 | breite Anwendung in DDR ab 1960, BRD ab 1962, IPV seit 1998 |
| Mumps | Mumpsvirus | Mumpsimpfstoff | 1967 | |
| Masern | Masernvirus | Masernimpfstoff | 1968 | |
| Röteln | Rötelnvirus | Rötelnimpfstoff | 1969 | |
| FSME | FSME-Virus | FSME-Impfstoff | 1973 | |
| Windpocken | Varizella-Zoster-Virus | Varizellaimpfstoff | 1974 | seit 2004 allgemeine Kinderimpfung in D empfohlen |
| Lungenentzündung | Pneumokokken-Bakterien | Pneumokokkenimpfstoff | 1977/2000 | seit 2006 allgemeine Kinderimpfung in D empfohlen |
| Hepatitis B | Hepatitis-B-Virus | Hepatitis-B-Impfstoff | 1981 | seit 1995 allgemeine Kinderimpfung in D empfohlen |
| Meningitis | Meningokokken-Bakterien Gruppe C | Meningokokkenimpfstoff Men C | 2001 | seit 2006 allgemeine Kinderimpfung in D empfohlen |
| Meningokokken-Bakterien Gruppen A, C, W, Y | Meningokokkenimpfstoff MenACWY | 2010/2012 | seit 2010 als Indikationsimpfung empfohlen | |
| Meningokokken-Bakterien Gruppe B | Meningokokkenimpfstoff MenB | 2013/2017 | seit 2015 als Indikationsimpfung empfohlen | |
| Haemophilus Influenzae Typ b | Haemophilus-Influenzae-Bakterien | Haemophilusimpfstoff | 1985 | seit 1990 allgemeine Kinderimpfung in D empfohlen |
| Hepatitis A | Hepatitis-A-Virus | Hepatitis-A-Impfstoff | 1992 | |
| Schwerer Durchfall | Rotavirus | Rotavirusimpfstoff | 1998/2005 | für Kinder unter 6 Monaten |
| Gebärmutterhalskrebs | Humane Papillomviren | HPV-Impfstoff | 2006 | auch Krebsvorstufen und Condylomata acuminata im Anogenitalbereich („Feigwarzen“) |
| Japanische Enzephalitis | Japanische Enzephalitis | Japanische-Enzephalitis-Impfstoff | 2009 (in Europa) | Vorher anderer Impfstoff in Asien erhältlich, in den USA wurde dieser 1992 eingeführt |
| COVID-19 | SARS-CoV-2 | COVID-19-Impfstoff | 2020/21 | durch EMA bedingt zugelassen |
-
Weltweite Durchimpfungsraten bei Einjährigen
Impfungen für Tiere

Auch viele Haustiere können und sollten nach herrschender Meinung geimpft werden. Die empfohlenen Impfungen werden vom Tierarzt verabreicht und ebenso wie beim Menschen in einem Impfpass dokumentiert. In Deutschland erarbeitet die Ständige Impfkommission Veterinärmedizin (StIKo Vet.) im Bundesverband praktizierender Tierärzte Impfempfehlungen für die Deutsche Kleintierpraxis.[124] Im Gegensatz zu den Impfungen beim Menschen werden die meisten Impfungen bei Tieren unter die Haut (subkutan) – meist im Bereich der Flanken oder im Nackenbereich – verabreicht. 2011 wurde in Deutschland ein Umsatz von 191 Millionen Euro mit Tierimpfstoffen erzielt, je etwa zur Hälfte bei Nutz- und Heimtieren.[125]
Die Impfung gegen Tollwut und der Nachweis im neuen EU-Heimtierausweis sind gesetzlich in praktisch allen europäischen Staaten für die Einreise von Hunden, Katzen und Frettchen erforderlich. Sie muss nach Vorschrift des Impfstoffherstellers wiederholt werden (ein bis drei Jahre) und die letzte muss für die meisten Staaten mindestens 30 Tage zurückliegen. Nach Änderung der deutschen Tollwutimpfverordnung ist seit 2006 eine jährliche Auffrischung nicht mehr vorgeschrieben, wenn der Hersteller eine längere Frist angibt.
Auch Nutztiere wie Schweine, Rinder oder Schafe können gegen diverse Krankheiten geimpft werden. Dies führt laut Hersteller der Impfstoffe in der Folge zu einer verbesserten Mastleistung bzw. höherem Milchertrag und senkt gleichzeitig den Einsatz von Antibiotika.
Für bestimmte Tierseuchen kann die Impfung nach dem Tierseuchengesetz staatlich angeordnet werden. Die Kosten für diese Impfungen werden von den Tierseuchenkassen ersetzt, für einige Impfungen besteht in Hinblick auf die Sanierung der Bestände eine Teilerstattung der Kosten. Die Impfung aller empfänglichen Tiere um einen Seuchenherd (Ringimpfung) kann die Ausbreitung einer Seuche zu verhindern.
Andere prophylaktische Impfungen sind bei Nutztieren hingegen verboten. Stattdessen ist die Tötung erkrankter Tiere vorgesehen. Nur für Notfälle gibt es Bestände von Impfstoffen.
Die prophylaktische Impfung gegen die Maul- und Klauenseuche (MKS), die in Deutschland bereits durchgeführt wurde, wurde im Jahr 1991 in Europa durch die EU verboten. Stattdessen müssen bei Auftreten von MKS alle Klauentiere des betroffenen Bestandes unter strengen Sicherheitsmaßnahmen getötet und unschädlich beseitigt werden. Für Notfälle ist jedoch auf der Insel Riems eine Impfstoffbank eingerichtet worden. Das Verbot der MKS-Impfung war insbesondere politisch motiviert (Exportfähigkeit des Fleischs u. a.) und ist sehr umstritten, seit im Jahr 2001 in Großbritannien über vier Millionen Tiere gekeult wurden.
Hunde
Haushunde werden zumeist gegen Staupe, Hepatitis contagiosa canis, Leptospirose (Stuttgarter Hundeseuche), Parvovirose (Katzenseuche des Hundes), Parainfluenza und Tollwut geimpft. Jüngere Untersuchungen zeigen, dass ein Impfschutz (mit Ausnahme Leptospirose) über drei Jahre und mehr bestehen kann, mittlerweile weisen viele Hersteller ihre Impfstoffe mit einer Wirkdauer von drei Jahren aus. Weniger verbreitet ist die Impfung gegen Lyme-Borreliose und die bakterielle Komponente des Zwingerhustens (Bordetella bronchiseptica). Nur im züchterischen Bereich spielen ferner Impfungen gegen das Welpensterben eine Rolle.
Die Impfung gegen Tollwut und deren Dokumentation im EU-Heimtierausweis ist nur noch bei Reisen zwingend erforderlich. Beißt das Tier einen Menschen, wird allerdings der behandelnde Arzt unter Umständen den Verdacht äußern, das Tier sei tollwütig. Dieser Verdacht zieht zwingend die Tötung des Tieres nach sich und kann nur entkräftet werden durch den Nachweis einer Impfung des Hundes oder der Katze gegen Tollwut innerhalb der letzten drei Jahre. Ansonsten wird innerhalb Deutschlands diese Impfung nicht mehr für nötig gehalten. Kann bei Kontrollen eine gültige Impfung nicht anhand EU-Heimtierausweises nachgewiesen werden, wird die Einreise in das Zielland verwehrt. Gleiches kann bei der Einreise bei der Rückkehr nach Deutschland, Österreich oder der Schweiz passieren. Eine jährliche Auffrischungsimpfung für Tollwut ist (gemäß Verordnung (EU) Nr. 576/2013 für Reisen innerhalb der EU, außer den Sonderbestimmungen oben genannter Länder) nicht mehr erforderlich, es gelten die Wiederholungsimpftermine der Impfstoffhersteller.[126]
Die Ständige Impfkommission Vet. (StIKO Vet.) zählt Impfungen gegen Parvovirose, Staupe, Leptospirose, Hepatitis contagiosa canis und Tollwut zu den Core-Komponenten: Gegen diese Erkrankungen sollte jeder Hund zu jeder Zeit geschützt werden. Impfungen gegen Bordetella bronchiseptica, Canines Herpesvirus, Canines Parainfluenzavirus, Dermatophytosen, Leishmaniose und Lyme-Borreliose zählt sie hingegen zu den Non-Core-Komponenten: Eine Impfung gegen diese Erkrankungen wird nur unter bestimmten Bedingungen oder in Ausnahmesituationen empfohlen (Stand: Januar 2021).[127]
Katzen

In Deutschland werden von der StIKO Vet. Empfehlungen für die Impfungen von Katzen herausgegeben.[128]
Für Katzen (hier vor allem bei der FeLV-Impfung) und in eingeschränktem Maße auch für Hunde ist das Auftreten vakzineassoziierter Tumoren (Fibrosarkome) dokumentiert. Verantwortlich hierfür sind möglicherweise den Impfstoffen zugesetzte Wirkungsverstärker (Adjuvanzien), auf die der Organismus vielleicht mit Tumorbildung reagieren kann. Andere Studien legen eher den Zusammenhang mit der Unterhautverletzung durch eine Injektionsnadel nahe, da der Tumor auch an Einstichstellen auftrat, die nicht der Impfung dienten und bei denen keine Adjuvanzien beteiligt waren. Obwohl die Inzidenz dieser Nebenwirkung mit etwa 1:10.000 im Bezug zum erreichten Schutz vor Erkrankungen vergleichsweise gering ist, werden Impfungen bei Katzen vorzugsweise im Bereich der Flanke empfohlen, um beim Auftreten dieses lokal aggressiven Tumors Raum zur chirurgischen Intervention zu lassen.[129]
| Infektionskrankheit | Auslöser | Anmerkungen |
|---|---|---|
| Katzenschnupfen | Verschiedene Erreger | Empfohlen. |
| Panleukopenie (Katzenseuche) | Parvoviridae | Empfohlen. |
| Tollwut | Rabiesvirus | Freigänger sollten auch gegen Tollwut geimpft werden. Die Tollwutimpfung wird trotz der gegenwärtigen Freiheit von terrestrischer Tollwut im deutschsprachigen Raum empfohlen, weil die Tiere bei Kontakt mit einem tollwutkranken Tier bessergestellt sind. |
| Katzenleukämie | Felines Leukosevirus (FeLV) | Eine Impfung gegen das Feline Leukosevirus (FeLV) empfiehlt sich nur bei bis zu acht Jahre alten Freigänger-Katzen. |
| Feline infektiöse Peritonitis (FIP) | Felines Enterales Coronavirus (FeCV) | Die Impfung gegen Feline Infektiöse Peritonitis (FIP) ist allenfalls bei negativem FeCV-Status angebracht und bietet keinen sicheren Schutz.[130] |
Frettchen
Frettchen werden meist in Ermangelung für diese Tierart zugelassener Impfstoffe mittels Kombinationsimpfstoffen von Hunden vakziniert. Rechtlich ist diese Vorgehensweise problematisch, da bei strenger Auslegung des Arzneimittelrechts Hundeimpfstoffe nicht für Frettchen eingesetzt werden dürfen. In Deutschland gibt es für Frettchen zugelassene Impfstoffe gegen Staupe und Tollwut.[131]
Kaninchen
Hauskaninchen können gegen Myxomatose und RHD (Chinaseuche) geimpft werden. Auch für den Schutz vor dem ansteckenden Kaninchenschnupfen (Rhinitis contagiosa) ist eine Impfung möglich, die jedoch nur in größeren Beständen sinnvoll ist. Nach der Grundimmunisierung ist eine jährliche, bei den meisten Myxomatose-Impfstoffen sogar eine halbjährliche Wiederholung notwendig.[132]
Pferde
Die StIKO Vet. empfiehlt für Pferde Impfungen gegen Wundstarrkrampf, Pferdeinfluenza, EHV-1 und EHV-4 (Rhinopneumonitis, Virusabort). Die Pferdeinfluenza-Impfung ist bei Teilnahme an Turnieren durch die FN vorgeschrieben. Als noncore-Impfungen, also solchen, die nur unter bestimmten Voraussetzungen empfohlen werden, gelten die gegen Druse, Tollwut, Equine Arteritis, Equine Rotavirus-Infektionen, West-Nil-Virus-Infektion und Dermatophytosen.[133]
Rinder und kleine Wiederkäuer
Für Rinder und kleine Wiederkäuer (Schafe usw.) bestehen in Deutschland mehrere Verordnungen und die Empfehlungen der StIKO Vet. Unterschieden werden bei den Impfempfehlungen für Rinder die Milcherzeugung, Mutterkuhhaltung und Rindermast.[134]
| Infektionskrankheit | Auslöser | Anmerkungen |
|---|---|---|
| Maul- und Klauenseuche | Maul-und-Klauenseuche-Virus | Nach § 2 der MKS-Verordnung sind Impfungen vorbehaltlich des Absatzes 2 und des § 16 verboten. |
| Bovines-Herpesvirus-1-Infektion | Bovines Herpesvirus 1 | Impfung, die staatlich angeordnet werden kann und von der Tierseuchenkasse kostenerstattet wird. |
| Rauschbrand | Clostridium chauvoei | Betroffen sind Rinder und Schafe. Grundsätzlich ist die Impfung zunächst nicht erlaubt. Sie kann in Deutschland nach § 9 der Verordnung zum Schutz gegen den Milzbrand und den Rauschbrand staatlich angeordnet werden und wird von der Tierseuchenkasse kostenerstattet. |
| Bovine Virusdiarrhoe | Bovines Virusdiarrhoe-Virus | Eine Teilerstattung der Kosten gibt es für Impfungen gegen Bovine Virusdiarrhoe/Mucosal Disease der Rinder (BVD/MD).
Der mittlerweile in der EU vom Markt genommene BVD-Impfstoff von Pfizer ist der wahrscheinliche Auslöser der Bovinen Neonatalen Panzytopenie.[135] |
Schweine
Für Schweine bestehen in Deutschland mehrere Verordnungen und die Empfehlungen der StIKO Vet.[136]
| Infektionskrankheit | Auslöser | Anmerkungen |
|---|---|---|
| Aujeszkysche Krankheit | Aujeszky-Virus | Nach § 3 der Verordnung zum Schutz vor der Aujeszkyschen Krankheit sind Impfungen verboten. Die Impfung kann staatlich angeordnet und von der Tierseuchenkasse kostenerstattet werden. |
Geflügel
| Infektionskrankheit | Auslöser | Anmerkungen |
|---|---|---|
| Salmonellose | Salmonella Enteritidis | Rechtlich vorgeschrieben ist in Deutschland die Impfung von Küken und Junghennen in Hühneraufzuchtbetrieben gegen Salmonella Enteritidis (§ 13 GflSalmoV). Diese Vorschrift gilt seit Neufassung der Hühner-Salmonellen-Verordnung 2009 für Betriebe ab 350 gehaltenen Tieren. |
| Salmonellose | Salmonella typhimurium | Bis 2009 war eine Impfung ab 250 Tieren und auch gegen Salmonella typhimurium verpflichtend (§ 2 Hühner-Salmonellen-Verordnung a.F.). |
| Newcastle-Krankheit | Für Hühner- und Truthühnerbestände besteht in Deutschland eine Impfpflicht.[137] | |
| Infektiöse Laryngotracheitis | Impfung sinnvoll[138] | |
| Infektiöse Bronchitis | Impfung sinnvoll[138] | |
| Aviäre Encephalomyelitis | Impfung sinnvoll[138] | |
| Vogelpocken | Impfung sinnvoll[138] | |
| Marek-Krankheit | Hühner-Herpesvirus 2 | Impfung sinnvoll[138] |
| Paramyxovirose | Pigeon paramyxovirus 1 | Bei Zucht- und Wildtauben, gelegentlich auch bei Hühnern, Wild- und Ziervögeln. Eine Impfung gegen Paramyxovirose ist verfügbar und wird in Deutschland von vielen Taubenzüchtervereinen für Mitglieder und Veranstaltungsteilnehmer vorgeschrieben. |
Siehe auch
Literatur
- Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 9. Auflage. Thieme, Stuttgart 2017, ISBN 978-3-13-242163-9.
- Volker Klippert, Ulrike Röper, Roland J. Riedl-Seifert: Impfen und Recht. Zuckschwerdt, Germering 2003, ISBN 3-88603-826-2.
- Christian Koller: Von der Impfkuh zum mRNA-Booster: Impfgeschichte als Gesellschaftsgeschichte. In: SozialarchivInfo. Nr. 1, 2022, S. 16–35.
- Horst Kremling: Historische Betrachtungen zur präventiven Heilkunde. In: Würzburger medizinhistorische Mitteilungen. Nr. 24, 2005, S. 222–260.
- Ute Quast, Sigrid Ley: Schutzimpfungen im Dialog. 2. Auflage. Kilian, Marburg 1999, ISBN 3-932091-41-8.
- Johannes-Peter Rupp (Hrsg.): Hundert Jahre Impfgesetz. Ausstellungskatalog. Universitätsbibliothek, Gießen 1974 (uni-giessen.de – Digitalisat).
- Reiner Thomssen: Schutzimpfungen. Grundlagen, Vorteile, Risiken. Beck, München 2001, ISBN 3-406-44775-9.
- Christiane Meyer, Sabine Reiter: Impfgegner und Impfskeptiker. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, Nr. 47, 2004, S. 1182–1188; doi:10.1007/s00103-004-0953-x, edoc.rki.de (PDF; 255 kB).
- Burkhard Schneeweiß, Michael Pfleiderer, Brigitte Keller-Stanislawski: Impfsicherheit heute. In: Deutsches Ärzteblatt. Band 105, Nr. 34–35, 2008, S. 590–595 (online).
- Axel Helmstädter: Zur Geschichte der aktiven Immunisierung. In: Pharmazie in unserer Zeit. Band 37, Nr. 1, 2008, ISSN 0048-3664, S. 12–18.
- Iris Ritzmann: Impfung. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 660–664.
- Malte Thießen: Vorsorge als Ordnung des Sozialen: Impfen in der Bundesrepublik und der DDR. In: Zeithistorische Forschungen. Band 10, Heft 3, 2013, ISSN 1612-6033, S. 409–432; zeithistorische-forschungen.de
- Malte Thießen: Immunisierte Gesellschaft: Impfen in Deutschland im 19. und 20. Jahrhundert. Vandenhoeck & Ruprecht, 2017, ISBN 978-3-647-37053-8.
- Ilse Zündorf, Angelika Vollmar, Theodor Dingermann: Immunologische Grundlagen des Impfens. In: Pharmazie in unserer Zeit. Band 37, Nr. 1, 2008, ISSN 0048-3664, S. 20–27.
- Das Impfbuch für Alle. 1. Auflage. Robert Koch-Institut / Bundeszentrale für gesundheitliche Aufklärung, Juni 2021 (bundesregierung.de als PDF abrufbar oder kostenfrei auf Bestellung lieferbar).
- Sebastian Wendt et al.: CME Zertifizierte Fortbildung Impfungen. Springer Medizin-Verlag, 28. September 2021; PMC 8552433 (freier Volltext).
- Impfgesetz des Deutschen Reichs vom 8. April 1874; Volltext auf Wikisource.
- Auszug aus einem Urtheile des k. Oberlandesgerichts München vom 2. März 1886. In: Amtsblatt des K. Staatsministeriums des Innern, Königreich Bayern, Band 1886, Nr. 18, S. 142–144 (zum Impfzwang); Volltext auf Wikisource.
Rundfunksendungen
- Mirko Smiljanic: Glaubensstreit um kleinen Pieks – Diskussion über die Vor- und Nachteile von Impfungen. In: dradio Hintergrund. 28. August 2013.
- Volkart Wildermuth: Impfungen mit „Mehrwert“ – Manche schützen vor mehreren Krankheiten zugleich. In: SWR2 Wissen. 25. Februar 2015.
Weblinks
- Impfen – Impfmythen: Falschinformationen wirksam aufklären. Robert Koch-Institut
- Impfen auf kindergesundheit-info.de, dem Informationsangebot der Bundeszentrale für gesundheitliche Aufklärung (BZgA)
- Impfung, Infektionskrankheiten, Immunisierung, Impfstoffe, Impfreaktionen, Impfkalender – Informationen der Bundeszentrale für gesundheitliche Aufklärung (BZgA)
- Das Impfbuch für alle. BZgA, RKI, BMG, abgerufen am 3. Dezember 2021.
- Impfungen für Säuglinge und Kinder des Bundesamts für Gesundheit der Schweiz
- Infos zu Impfungen bei Kindern vom Berufsverband der Kinder- und Jugendärzte
Englischsprachig
- 'Pink Book' – Standardwerk für Impfungen des Centers for Disease Control and Prevention (CDC) der USA
- Seiten über Impfungen (englisch) der Weltgesundheitsorganisation (WHO)
- Samantha Vanderslott, Bernadeta Dadonaite und Max Roser: Vaccination. In: Our World in Data. September 2019 (englisch, Online [abgerufen am 12. Januar 2020]).
Einzelnachweise
- ↑ § 2 Nr. 9 des Infektionsschutzgesetzes
- ↑ L. A. Jackson, D. Peterson, J. C. Nelson, S. M. Marcy, A. L. Naleway, J. D. Nordin, J. G. Donahue, S. J. Hambidge, C. Balsbaugh, R. Baxter, T. Marsh, L. Madziwa, E. Weintraub: Vaccination site and risk of local reactions in children 1 through 6 years of age. In: Pediatrics. Band 131, Nummer 2, Februar 2013, S. 283–289, doi:10.1542/peds.2012-2617. PMID 23319538.
- ↑ Kampf gegen Infektionskrankheiten: Erster mRNA-Impfstoff: Diese Technologie könnte Covid-19 besiegen – und nicht nur das. Abgerufen am 2. Dezember 2020.
- ↑ A. F. Ochsenbein, D. D. Pinschewer, S. Sierro, E. Horvath, H. Hengartner, R. M. Zinkernagel: Protective long-term antibody memory by antigen-driven and T help-dependent differentiation of long-lived memory B cells to short-lived plasma cells independent of secondary lymphoid organs. In: Proceedings of the National Academy of Sciences. Band 97, Nummer 24, November 2000, S. 13263–13268, doi:10.1073/pnas.230417497. PMID 11069289, PMC 27213 (freier Volltext).
- ↑ Navigation – Welche Abstände sind zwischen Impfungen einzuhalten? In: RKI. 25. Juni 2020, abgerufen am 26. Dezember 2020.
- ↑ Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie. 5. Auflage. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-125315-6, S. 731.
- ↑ Margret Oethinger: Kurzlehrbuch Mikrobiologie und Immunologie. 11. Auflage. Urban & Fischer, München 2004, ISBN 978-3-437-42781-7, S. 275.
- ↑ Antje Hüter-Becker: Untersuchen in der Physiotherapie, S. 157.
- ↑ Andreas Hummel: Arzneimittellehre. Vincentz Network, 2004, ISBN 3-87870-482-8, S. 544 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 58.
- ↑ Immunschutz durch Muttermilch. (Online [abgerufen am 31. Juli 2018]).
- ↑ Antworten des Robert Koch-Instituts und des Paul-Ehrlich-Instituts zu den 20 häufigsten Einwänden gegen das Impfen. Ein Baby bekommt von der Mutter Abwehrstoffe. Dieser natürliche Schutz reicht doch aus. In: RKI. 22. April 2016, abgerufen am 10. Mai 2021.
- ↑ RKI – Bedeutung von Impfungen – Antworten des Robert Koch-Instituts und des Paul-Ehrlich-Instituts zu den 20 häufigsten Einwänden gegen das Impfen. Abgerufen am 31. Juli 2018.
- ↑ Centers for Disease Control and Prevention (CDC): Impact of Vaccination Universally Recommended for Children – United States, 1900–1998. In: MMWR, Morbidity and Mortality Weekly Report. Band 48, Nr. 12, April 1999, S. 243–248, PMID 10220251.
- ↑ pei.de (PDF; 109 kB) Mitteilung des Paul-Ehrlich-Institutes zu Impfstoffzulassungen, abgerufen am 30. Jan. 2021.
- ↑ Centers for Disease Control and Prevention; J. Hamborsky, A. Kroger, S. Wolfe (Hrsg.): Epidemiology and Prevention of Vaccine-Preventable Diseases – The Pink Book. 13. Auflage. 2. Druck. Public Health Foundation, Washington DC 2015, Onlineausgabe, abgerufen am 27. Juli 2017.
- ↑ Schutzimpfungen – 20 Einwände und Antworten des Robert Koch-Instituts und des Paul-Ehrlich-Instituts. Robert Koch-Institut, 23. Oktober 2013, abgerufen am 4. Januar 2015.
- ↑ S. W. Roush, T. V. Murphy; Vaccine-Preventable Disease Table Working Group: Historical comparisons of morbidity and mortality for vaccine-preventable diseases in the United States. In: JAMA. Band 298, Nr. 18, 2007, S. 2155–2163, PMID 18000199.
- ↑ V. A. Blaho, M. W. Buczynski, E. A. Dennis, C. R. Brown: Cyclooxygenase-1 orchestrates germinal center formation and antibody class-switch via regulation of IL-17. In: Journal of Immunology. Band 183, Nummer 9, November 2009, S. 5644–5653, doi:10.4049/jimmunol.0901499. PMID 19843949, PMC 2857380 (freier Volltext).
- ↑ Roman Prymula, C. A. Siegrist, R. Chlibek, H. Zemlickova, M. Vackova, J. Smetana, P. Lommel, E. Kaliskova, D. Borys, L. Schuerman: Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. In: The Lancet. Band 374, Nummer 9698, Oktober 2009, S. 1339–1350, doi:10.1016/S0140-6736(09)61208-3. PMID 19837254. (PDF) ( vom 14. November 2011 im Internet Archive)
- ↑ Common Pain Relievers May Dilute Power of Flu Shots. University of Rochester Medical Center (URMC), abgerufen am 27. Juli 2011.
- ↑ Schmerzmittel schwächen Impfschutz. Spiegel online, abgerufen am 4. Dezember 2009.
- ↑ M. P. Bernard, R. P. Phipp: Inhibition of cyclooxygenase-2 impairs the expression of essential plasma cell transcription factors and human B-lymphocyte differentiation. In: Immunology. Band 129, Nr. 1, 2010, S. 87–96, PMID 20050331.
- ↑ S. Bancos, M. P. Bernard, D. J. Topham, R. P. Phipps: Ibuprofen and other widely used non-steroidal anti-inflammatory drugs inhibit antibody production in human cells. In: Cell Immunol. Band 258, Nr. 1, 2009, S. 18–28, PMID 19345936.
- ↑ Over-the-Counter Pain Drugs May Affect Vaccine Strength. WXXI, abgerufen am 27. Juli 2011.
- ↑ Impfeffekt kann durch manche Medikamente deutlich abgeschwächt werden. Lungenärzte im Netz, abgerufen am 4. Dezember 2009.
- ↑ Effect of Prophylactic Paracetamol Administration at Time of Vaccination on Febrile Reactions and Antibody Responses in Children F1000 Ranking: „Exceptional“ and Changes Clinical Practice". Medscape, abgerufen am 26. Juli 2011.
- ↑ D. D. Taub, W. B. Ershler, M. Janowski, A. Artz, M. L. Key, J. McKelvey, D. Muller, B. Moss, L. Ferrucci, P. L. Duffey, D. L. Longo: Immunity from smallpox vaccine persists for decades: a longitudinal study. In: The American journal of medicine. Band 121, Nummer 12, Dezember 2008, S. 1058–1064, doi:10.1016/j.amjmed.2008.08.019. PMID 19028201, PMC 2610468 (freier Volltext).
- ↑ I. Davidkin, S. Jokinen, M. Broman, P. Leinikki, H. Peltola: Persistence of measles, mumps, and rubella antibodies in an MMR-vaccinated cohort: a 20-year follow-up. In: The Journal of infectious diseases. Band 197, Nummer 7, April 2008, S. 950–956, doi:10.1086/528993. PMID 18419470.
- ↑ A. M. Wendelboe, A. Van Rie, S. Salmaso, J. A. Englund: Duration of immunity against pertussis after natural infection or vaccination. In: The Pediatric infectious disease journal. Band 24, Nummer 5, Mai 2005, Supplement, S. S58–S61. PMID 15876927.
- ↑ Was bedeutet „2+1 bzw. 3+1 Schema“? In: Impfen mit Vernunft. 4. August 2017, abgerufen am 13. März 2020.
- ↑ mit Ausnahme des COVID-19-Impfstoffs Ad26.COV2.S (Janssen / Johnson & Johnson), von dem zur Grundimmunisierung nur eine Dosis verimpft wurde
- ↑ Beschluss der STIKO zur 14. Aktualisierung der COVID-19-Impfempfehlung. In: Robert Koch-Institut (Hrsg.): Epidemiologisches Bulletin. Band 48, 29. November 2021, S. 3–14, hier S. 9 f., doi:10.25646/9326 (rki.de [abgerufen am 29. Juni 2022]).
- ↑ „Beschluss der STIKO zur 16. Aktualisierung der COVID-19-Impfempfehlung“ und „Wissenschaftliche Begründung der STIKO für die Empfehlung zur Verkürzung des Impfabstands zwischen Grundimmunisierung bzw. Infektion und Auffrischimpfung auf einen Zeitraum ab 3 Monate“. In: Epidemiologisches Bulletin 2/2022. Robert Koch-Institut (RKI), 21. Dezember 2021, abgerufen am 25. Dezember 2021 (Diese Artikel wurden am 21. Dezember 2021 online vorab veröffentlicht.).
- ↑ In den USA ist für Kinder und Jugendliche zwischen 5 und 17 Jahren nur der Biontech/Pfizer-Impfstoff Tozinameran zugelassen (Quelle)
- ↑ Sicherheit von Impfungen. In: RKI. 26. Februar 2021, abgerufen am 14. Oktober 2021.
- ↑ a b C. Meyer, S. Reiter: Impfgegner und Impfskeptiker – Geschichte, Hintergründe, Thesen, Umgang. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 47. Springer Medizin Verlag, Dezember 2004, S. 1182–1188, doi:10.1007/s00103-004-0953-x (rki.de [PDF; abgerufen am 30. April 2015]).
- ↑ Carlo Di Pietrantonj et al.: Vaccines for measles, mumps, rubella, and varicella in children. In: The Cochrane Database of Systematic Reviews. Band 11, 22. November 2021, S. CD004407, doi:10.1002/14651858.CD004407.pub5, PMID 34806766, PMC 8607336 (freier Volltext).
- ↑ Sind Impfmasern ansteckend und wie werden sie diagnostiziert? In: RKI. 4. Juni 2020, abgerufen am 5. Januar 2021.
- ↑ a b Beate Schumacher: Seltener Notfall: Impfung kann anaphylaktische Reaktion auslösen. 20. Oktober 2016, abgerufen am 12. Oktober 2019.
- ↑ a b Oliver Klein, Katja Belousova: Impfstoffe: Warum es keine Langzeit-Nebenwirkungen gibt. In: ZDF. 6. Januar 2021, abgerufen am 14. Januar 2021.
- ↑ Meldeverpflichtung Paul-Ehrlich-Institut.
- ↑ Vergl. Infektionsschutzgesetz, 12. Abschnitt, § 61 Gesundheitsschadensanerkennung
- ↑ B. Keller-Stanislawski et al.: Verdachtsfälle von Impfkomplikationen nach dem IfSG und Verdachtsfälle von Nebenwirkungen nach dem Arzneimittelgesetz vom 1. Januar 2001 bis zum 31. Dezember 2003. In: Bundesgesundheitsblatt. Band 47, 2004, S. 1151–1164 doi:10.1007/s00103-004-0946-9.
- ↑ Matthew Z. Dudley et al.: The state of vaccine safety science: systematic reviews of the evidence. In: The Lancet Infectious Diseases. Band 20, Nr. 5, 1. Mai 2020, S. e80–e89, doi:10.1016/S1473-3099(20)30130-4, PMID 32278359.
- ↑ STIKO: Mitteilung der Ständigen Impfkommission am Robert Koch-Institut (RKI). Empfehlungen der Ständigen Impfkommission am Robert Koch-Institut/Stand: August 2014. (PDF; 241 KB). In: Epidemiologisches Bulletin. Nr. 34, 2014.
- ↑ Impfungen bei Vorerkrankungen: Häufig gestellte Fragen und Antworten. Impfen bei Epilepsie und bei neurologischen Schäden? In: RKI. 14. Dezember 2012, abgerufen am 27. Januar 2022.
- ↑ a b Ingrid Rosian, Claudia Habl: Impfungen. Ökonomische Evaluation. Hrsg.: Österreichisches Bundesinstitut für Gesundheitswesen. 2003, ISBN 978-3-85159-061-6 (Online [abgerufen am 28. Dezember 2020]).
- ↑ Silvia Evers et al.: Cost-effectiveness of pneumococcal vaccination for prevention of invasive pneumococcal disease in the elderly: an update for 10 Western European countries. In: European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. Band 26, Nr. 8, August 2007, S. 531–540, doi:10.1007/s10096-007-0327-z, PMID 17570001.
- ↑ a b Kirsten Vannice, Annelies Wilder-Smith, Joachim Hombach: Fractional-Dose Yellow Fever Vaccination — Advancing the Evidence Base. In: New England Journal of Medicine. Band 379, Nr. 7, 16. August 2018, ISSN 0028-4793, S. 603–605, doi:10.1056/NEJMp1803433, PMID 29995585.
- ↑ Modelling epidemics with fractional-dose vaccination in response to limited vaccine supply. In: Journal of Theoretical Biology. Band 486, 7. Februar 2020, ISSN 0022-5193, S. 110085, doi:10.1016/j.jtbi.2019.110085.
- ↑ Intradermal fractional dose inactivated polio vaccine: A review of the literature. In: Vaccine. Band 30, Nr. 2, 5. Januar 2012, ISSN 0264-410X, S. 121–125, doi:10.1016/j.vaccine.2011.11.018.
- ↑ Patrick Hunziker: Personalized-dose Covid-19 vaccination in a wave of virus Variants of Concern: Trading individual efficacy for societal benefit. In: Precision Nanomedicine. Band 4, Nr. 3, 24. Juli 2021, S. 805–820, doi:10.33218/001c.26101.
- ↑ History and Epidemiology of Global Smallpox Eradication. ( vom 15. Juli 2007 im Internet Archive) (PDF; 1,5 MB) From the training course Smallpox: Disease, Prevention, and Intervention. CDC and WHO. Slide 16–17.
- ↑ Impfen. Robert Koch-Institut, abgerufen am 9. Mai 2012.
- ↑ Achievements in Public Health, 1900–1999 Impact of Vaccines Universally Recommended for Children -- United States, 1990–1998. Centers for Disease Control and Prevention, abgerufen am 9. Mai 2012.
- ↑ Impfprogramm mit beispiellosem Erfolg. In: Ärzte Zeitung. Abgerufen am 9. Mai 2012.
- ↑ Maarten van Wijhe et al.: Effect of vaccination programmes on mortality burden among children and young adults in the Netherlands during the 20th century: a historical analysis. In: The Lancet Infectious Diseases. Band 16, Nr. 5, 1. Mai 2016, S. 592–598, doi:10.1016/S1473-3099(16)00027-X.
- ↑ Ten Great Public Health Achievements --- Worldwide, 2001–2010. Centers for Disease Control and Prevention, abgerufen am 9. Mai 2012.
- ↑ Ten Great Public Health Achievements – United States, 1900–1999. Centers for Disease Control and Prevention, abgerufen am 9. Mai 2012.
- ↑ Gary J. Nabel: Designing Tomorrow’s Vaccines. In: New England Journal of Medicine. Band 368, Ausgabe 6, 7. Februar 2013, S. 551–560.
- ↑ Colette Flight: Smallpox: eradicating the scourge. BBC. Publiziert am 17. Februar 2011. Abgerufen am 4. Januar 2015.
- ↑ Hanna Ronzheimer: Kinderlähmung. Die vergessene Epidemie. science.orf.at, 15. Juni 2020.
- ↑ WHO: Poliomyelitis in Namibia. Disease Outbreak News, 6. Juni 2006.
- ↑ Indien ist poliofrei. In: rki.de. 20. Januar 2014, abgerufen am 27. Dezember 2014.
- ↑ P. M. Oostvogel, J. K. van Wijngaarden, H. G. van der Avoort, M. N. Mulders, M. A. Conyn-van Spaendonck, H. C. Rümke, G. van Steenis, A. M. van Loon: Poliomyelitis outbreak in an unvaccinated community in The Netherlands, 1992–1993. In: The Lancet. Band 344, Nummer 8923, September 1994, S. 665–670. PMID 7915354.
- ↑ a b Robert Koch-Institut: Masern im Jahr 2005 und Ausbrüche in Baden-Württemberg und Nordrhein-Westfalen in der ersten Hälfte des Jahres 2006. In: Epidemiologisches Bulletin. Nr. 27, 7. Juli 2006; rki.de (PDF)
- ↑ survstat.rki.de
- ↑ Masernepidemiologie in der Schweiz: heute und in jüngster Zeit. In: BAG Bulletin. Nr. 17 vom 22. April 2013, S. 276–277.
- ↑ BAG: Neue Welle der Masernepidemie Anfang 2009: Beschreibung und Maßnahmen. In: BAG Bulletin. Nr. 27, 2009, S. 484–491, ZDB-ID 2556348-8.
- ↑ Global Measles and Rubella Strategic Plan 2012–2020. (PDF) Weltgesundheitsorganisation (WHO), 3. Mai 2012, abgerufen am 4. Januar 2015 (englisch)., ISBN 978-92-4-150339-6.
- ↑ Robert Koch-Institut: Impfpräventable Krankheiten in Deutschland bis zum Jahr 2000. In: Epidemiologisches Bulletin. Nr. 7, 2002, S. 49–60, doi:10.25646/4005.
- ↑ Robert Koch-Institut: Zum Auftreten von Pertussis in den neuen Bundesländern. In: Epidemiologisches Bulletin. Nr. 23, 2005, S. 195–202, doi:10.25646/4182.
- ↑ Erika J. Sims, Miranda Mugford, Allan Clark, David Aitken, Jonathan McCormick, Gita Mehta, Anil Mehta, on behalf of the UK Cystic Fibrosis Database Steering Committee: Economic implications of newborn screening for cystic fibrosis: a cost of illness retrospective cohort study. In: The Lancet. Band 369, Nr. 9568, 2007, S. 1187–1195, doi:10.1016/S0140-6736(07)60565-0.
- ↑ Renate Leinmüller, Rüdiger Meyer: Rotavirus-Infektionen: Orale Impfstoffe bieten umfassenden Schutz. In: Deutsches Ärzteblatt. Band 103, Nr. 40. Deutscher Ärzte-Verlag, 6. Oktober 2006, S. A-2650 (aerzteblatt.de).
- ↑ USA: Zulassung des ersten Impfstoffes gegen das Zervixkarzinom. In: aerzteblatt.de. 9. Juni 2006, archiviert vom (nicht mehr online verfügbar) am 20. Dezember 2014; abgerufen am 27. Dezember 2014.
- ↑ Eric von Hofe: Immuntherapie gegen Krebs. In: Spektrum der Wissenschaft. 23. September 2002, abgerufen am 23. Juni 2021.
- ↑ R. B. Belshe, K. M. Edwards, T. Vesikari, S. V. Black, R. E. Walker, M. Hultquist, G. Kemble, E. M. Connor: Live attenuated versus inactivated influenza vaccine in infants and young children. In: The New England Journal of Medicine. Band 356, Nummer 7, Februar 2007, S. 685–696, doi:10.1056/NEJMoa065368. PMID 17301299.
- ↑ P. Graves, H. Gelband: Vaccines for preventing malaria. In: The Cochrane database of systematic reviews. Nummer 1, 2003, S. CD000129, ISSN 1469-493X, doi:10.1002/14651858.CD000129. PMID 12535387. (Review).
- ↑ New Vaccines against Infectious Diseases: Research and Development Status. (PDF; 85 kB) WHO-Initiative for Vaccine Research, Februar 2006.
- ↑ Impfmüdigkeit – Folge eines trügerischen Gefühls der Sicherheit. Thieme (Nachdruck aus: Deutsche Medizinische Wochenschrift. 2005, Band 130, Nr. 7l, abgerufen am 11. Mai 2012.)
- ↑ Vaccine fatigue: the danger of measles. Infection Research, abgerufen am 11. Mai 2012.
- ↑ a b P. L. Lopalco, R. Martin: Measles still spreads in Europe: who is responsible for the failure to vaccinate? In: Euro Surveill. Band 15, Nr. 17, 2012, S. 19557, PMID 20460089 (eurosurveillance.org).
- ↑ M. Muscat, H. Bang, J. Wohlfahrt, S. Glismann, K. Mølbak: Measles in Europe: an epidemiological assessment. In: The Lancet. Band 373, Nummer 9661, Januar 2009, S. 383–389, doi:10.1016/S0140-6736(08)61849-8. PMID 19131097.
- ↑ Masern sind nur schwer auszurotten Warum Masern so gefährlich sind
- ↑ Gesetz zur Modernisierung der epidemiologischen Überwachung übertragbarer Krankheiten. (PDF) In: Bundesgesetzblatt. 24. Juli 2017, abgerufen am 12. Oktober 2020.
- ↑ "Quasi"-Impfpflicht in Deutschland: Kitas müssen Eltern ohne Impfberatung melden. In: Augsburger Allgemeine. Abgerufen am 12. Oktober 2020.
- ↑ Körperverletzung bei Impfung eines Kindes gegen den Willen der Mutter? Urteil vom 13. Juli 2007, Aktenzeichen: 5 Cs 135 Js 52229/04 (241/05).
- ↑ a b c d Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2023. (PDF) In: Epidemiologisches Bulletin 04/2023. RKI, abgerufen am 16. April 2023.
- ↑ Schweizerischer Impfplan. In: Bundesamt für Gesundheit BAG. 6. April 2020, abgerufen am 17. September 2020.
- ↑ Österreichisches Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz: Impfplan Österreich. Auf: sozialministerium.at vom 23. Dezember 2022.
- ↑ Coronavirus: Impfung. In: Bundesamt für Gesundheit. 3. April 2023, abgerufen am 16. April 2023.
- ↑ FAQ des Robert Koch-Instituts: Kann in der Schwangerschaft geimpft werden? Sind Impfungen in der Stillzeit möglich? Stand: 21. November 2012
- ↑ a b Tim Niehues, Christian Bogdan, Jane Hecht, Thomas Mertens, Miriam Wiese-Posselt: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen(I) Grundlagenpapier. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 60, Nr. 6, Juni 2017, ISSN 1436-9990, S. 674–684, doi:10.1007/s00103-017-2555-4 (springer.com [abgerufen am 13. Oktober 2021]).
- ↑ a b c d e f g h Norbert Wagner, Frauke Assmus, Gabriele Arendt, Erika Baum, Ulrich Baumann: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen. (IV) Impfen bei Autoimmunkrankheiten, bei anderen chronisch-entzündlichen Erkrankungen und unter immunmodulatorischer Therapie. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 62, Nr. 4, April 2019, ISSN 1436-9990, S. 494–515, doi:10.1007/s00103-019-02905-1 (springer.com [abgerufen am 13. Oktober 2021]).
- ↑ a b Stellen Autoimmunerkrankungen oder chronisch-entzündliche Erkrankungen Kontraindikationen gegen Impfungen dar? Robert-Koch-Institut, 16. Juni 2020, abgerufen am 9. Oktober 2021.
- ↑ Ärzte Zeitung, 28. Juli 2006.
- ↑ Epidemiologisches Bulletin Nr. 38 (PDF; 128 KB) des Robert Koch-Instituts vom 26. September 2011, S. 353.
- ↑ a b c Empfehlungen zu Nachholimpfungen. In: Epidemiologisches Bulletin. Band 34, 20. August 2020, S. 47 (Online [PDF]).
- ↑ Impfen: Häufig gestellte Fragen und Antworten. Wie soll bei fehlender Impfdokumentation vorgegangen werden? In: RKI. 14. Dezember 2012, abgerufen am 11. Mai 2021.
- ↑ SR 818.101 Art. 23 Impfungen (Bundesgesetz über die Bekämpfung übertragbarer Krankheiten des Menschen). In: admin.ch. Abgerufen am 27. Dezember 2014.
- ↑ Masernschutzgesetz. Robert Koch-Institut, 1. März 2020, abgerufen am 13. Oktober 2021.
- ↑ Andreas Hoffmann, Klaus Cußler: Impfkampagne zur Bekämpfung der Blauzungenkrankheit. (PDF) Erste Analyse und Bewertung der 2008 gemeldeten Impfreaktionen. In: Pharmakovigilanz. Paul Ehrlich Institut, abgerufen am 4. Januar 2015 (Kopie aus Deutsches Tierärzteblatt 2/2009, S. 166–168).
- ↑ Impfgegner: Von Aids-Leugnern und Verschwörungstheoretikern. In: Pharmazeutische Zeitung online. Abgerufen am 24. Juli 2017.
- ↑ Peter-Philipp Schmitt: Die Schweinegrippe-Verschwörung. In: FAZ.net. 20. August 2009, abgerufen am 27. Dezember 2014.
- ↑ Braucht Deutschland eine Impfpflicht? Tagesschau (ARD), abgerufen am 24. Juli 2017.
- ↑ Sven Ove Hansson: Science denial as a form of pseudoscience. In: Studies in History and Philosophy of Science. Band 63, 2017, S. 39–47, doi:10.1016/j.shpsa.2017.05.002.
- ↑ Stefanie Grossmann: Von Pocken bis Corona: Die Geschichte des Impfens. In: ndr.de, 12. November 2021, abgerufen am 18. November 2021.
- ↑ Angela Ki Che Leung: “Variolation” and Vaccination in Late Imperial China, Ca 1570–1911. In: Stanley A. Plotkin: History of Vaccine Development. Springer, New York (NY) 2011, ISBN 978-1-4419-1338-8, S. 5-12, doi:10.1007/978-1-4419-1339-5_2 ([1]).
- ↑ John B. Blake: The Inoculation Controversy in Boston: 1721–1722. In: The New England Quarterly. Band 25, Nr. 4, 1952, S. 489–506; JSTOR:362582.
- ↑ Margot Minardi: The Boston Inoculation Controversy of 1721–1722: An Incident in the History of Race. In: William and Mary Quarterly. Band 61, Nr. 1, 47. Januar 2004, doi:10.2307/3491675 ([2]).
- ↑ Kelly Wisecup: African Medical Knowledge, the Plain Style, and Satire in the 1721 Boston Inoculation Controversy. In: Early American Literature. Band 46, Nr. 1, 2011, S. 25–50 doi:10.1353/eal.2011.0004. ([3]).
- ↑ Sudhoffs Archiv. Zs. f. Wissenschaftsgeschichte, Band 90, Heft 2, 2006, S. 219–232.
- ↑ Georg Friedrich Ballhorn: Eduard Jenners der Arzneywissenschaft Doktors und Mitglieds der Königl. Societät der Wissenschaften Untersuchungen Über die Ursachen und Wirkungen Der Kuhpocken einer Krankheit die man in einigen westlichen Provinzen Englands vorzüglich in Gloucestershire bemerkt hat. 2. Ausgabe. Gebrüder Hahn, Hannover 1799.
- ↑ Irmtraut Sahmland: Ballhorn, Georg Friedrich. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 134 f.
- ↑ Georg Friedrich Ballhorn, Christian Friedrich Stromeyer: Traité de l’inoculation Vaccine avex l’exposé et les résultats des observations faites sur cet objet à Hannovre et dans les environs de cette capitale, par Mr. Ballhorn, Medecin de la cour et Mr. Stromeyer, Chirurgien de la cour. Rein, Leipzig 1801 (archive.org).
- ↑ Johann Carro im Wien Geschichte Wiki der Stadt Wien
- ↑ Th. Chr. Eulner im Dansk Biografisk Leksikon
- ↑ In Dänemark und Schleswig-Holstein mussten Konfirmanden und Brautpaare seit 1811 nachweisen, dass sie gegen Pocken geimpft waren. Dazu: Gerda Bonderup: Die Rolle der Geistlichen bei der Einführung der Pockenschutzimpfung in Dänemark. In: Manfred Jakubowski-Tiessen: Geistliche Lebenswelten: zur Sozial- und Mentalitätsgeschichte in Spätmittelalter und Früher Neuzeit. Studien zur Wirtschafts- und Sozialgeschichte Schleswig-Holstein, Neumünster 2005, S. 253–270.
- ↑ Malte Thießen: Vom immunisierten Volkskörper zum präventiven Selbst. Impfungen als Biopolitik und soziale Praxis vom Kaiserreich zur Bundesrepublik. In: Vierteljahrshefte für Zeitgeschichte. Band 61, 2013, S. 34–65, doi:10.1524/vfzg.2013.0002.
- ↑ Malte Thießen: Vorsorge als Ordnung des Sozialen: Impfen in der Bundesrepublik und der DDR. In: Zeithistorische Forschungen. Band 10, 2013, S. 428. zeithistorische-forschungen.de
- ↑ Der große Impfversuch von Konstantinopel. istanbulpark.de / web.archive.org ( vom 8. August 2016 im Internet Archive)
- ↑ a b c Iris Ritzmann: Impfung. Berlin 2005, S. 663.
- ↑ Information zur StIKo Vet. ( vom 18. März 2012 im Internet Archive)
- ↑ Mäßiger Umsatz bei Tierarzneimitteln. In: Dt. TÄBl. 60, Nr. 2012, S. 849.
- ↑ Uwe Truyen: Die Impfung des Hundes. (PDF; 534 kB) Uwe Truyen ist Vorsitzender der StIKo Vet.;
- ↑ Leitlinie zur Impfung von Kleintieren. (PDF) StIko Vet., 1. Januar 2021, abgerufen am 4. März 2021.
- ↑ STIKO Vet: Leitlinie zur Impfung von Kleintieren. (PDF)
- ↑ K. Wiedmann: Klinische Phase-I Studie zur neoadjuvanten immunstimulierenden Therapie des felinen Fibrosarkoms mit Interleukin-2 und Interferon gamma. Vet.-med. Diss., München 2005, S. 5–7; uni-muenchen.de (PDF; 6,9 MB; 7,3 MB)
- ↑ Die aktualisierten Impfleitlinien für Kleintiere und Pferde. In: Dt. TÄBl. Band 65, Heft 4, S. 460–461.
- ↑ Die aktualisierten Impfleitlinien für Kleintiere und Pferde. In: Dt. TÄBl. Band 65, Heft 4, S. 462.
- ↑ Anne Posthoff: Impfungen bei Heimtierkaninchen. In: Kleintiermedizin. 3/4-2010, S. 107–109.
- ↑ Die aktualisierten Impfleitlinien für Kleintiere und Pferde. In: Dt. TÄBl. Band 65, Heft 4, S. 463–464.
- ↑ STIKO Vet: Impfleitlinien Rinder und kleine Wiederkäuer. (PDF)
- ↑ M. Bastian, M. Holsteg, H. Hanke-Robinson, K. Duchow, K. Cussler: Bovine Neonatal Pancytopenia: is this alloimmune syndrome caused by vaccine-induced alloreactive antibodies? In: Vaccine. Band 29, Nummer 32, Juli 2011, S. 5267–5275, doi:10.1016/j.vaccine.2011.05.012. PMID 21605614.
- ↑ STIKO Vet: Impfleitlinien Schweine. (PDF)
- ↑ tierseucheninfo.niedersachsen.de
- ↑ a b c d e Anne Vits et al.: Tierseuchenrechtliche Hinweise zu Impfungen in Klein- und Hobby-Geflügelbeständen. (PDF) In: Lohmann Information. 3/2005, S. 1–2.
